
英语原文共 9 页,剩余内容已隐藏,支付完成后下载完整资料
生物炭中多环芳烃的定量测定:保证其质量和安全应用的先决条件
摘要:生物炭越来越多地被推广为有益的土壤改良剂。 然而,由于其通过热解产生,它可能含有多环芳烃(PAHs)的残余物。 迄今为止,几乎没有分析方法来定量分析生物炭中的多环芳烃。 本研究提出了一种优化和验证的方法来量化生物炭中的16种美国EPA PAHs。 PAHs最好用Soxhlet用100%甲苯萃取36小时。 用于来自三种不同生物炭的每种分析物的同位素标记内标的平均绝对回收率为42%至72%,相对回收率为71%至105%。 检测限是生物炭依赖性的,但平均比定量PAH浓度(9-355 mg/ kg干重)低50倍。 已建立的方法为生物炭PAH分析的协调协议奠定了基础,生物炭质量控制,注册和立法的必要性。
关键词:生物炭,木炭,多环芳烃,总浓度,提取方法
介绍
生物炭是通过生物质热解产生的木炭,用作土壤改良剂,以隔离碳并同时改善土壤功能[1],[2]。虽然生物炭土壤改良有一系列积极影响(如微生物生物量和微生物增加)活性,增加植物产量,浸灰效应,增强有机污染物的吸附能力),仍然有许多未知数(例如,关于碳负性,对营养循环和可用性的影响,土壤 - 水家庭),甚至消极方面已经说明(例如,生物炭生产过程中的作物残留物去除,职业健康和火灾危险)[2]。在后者中,污染土壤的风险似乎是固有的,因为生物炭可能含有大量的多环芳烃(PAHs)如生物炭相关燃烧/热解材料中PAH残留的几个报道所示。例如,Brown等人[3]合成木炭中的浓度为3至28 mg /kg(40种单独PAHs的总和),Jonker和Koelmans[4]报告了含有45 mg/ kg PAHs的木炭(13种单独化合物的总和),Schimmelpfennig和Glaser[5]发现平均浓度范围为3.9(Pyreg)至2945 mg/ kg(木材气化炉)。除此之外,PAHs的含量在生物炭几乎没有被系统地研究过,也没有生物炭生产过程中最小化的措施。此外,几乎没有可用于生物炭中PAH分析的特别适用和验证的方法。以前使用的描述是从生物炭中提取总PAH的通用方法,例如,在Singh等人[6]中发现,他们确定了lt;0.5 mg /kg PAHs的“可忽略”浓度,并得出结论,这些低水平“使这些生物炭可安全用于土壤施用”。然而,Singh等人使用12小时索氏提取二氯甲烷,这可能不是理想的提取溶剂,Fernandes和Brooks[7]表示,提取样品(即稻草和木炭,植物火灾残留物和烟囱烟灰)“用二氯甲烷或二氯甲烷和甲醇的混合物显示低浓度PAH内标的回收率。为了解决这个问题,使用己烷作为萃取溶剂。“Schimmelpfennig和Glaser5使用己烷进行8小时索氏提取,这是德国TUuml;V的一种通用方法,用于量化不同生产的生物炭中的PAHs。 Gomez-Eyles等[8]使用丙酮/己烷(1:1)定量生物炭中的PAH仅为1.2 mg/ kg。 Brown等人使用由Poster等人[9]早先建立的柴油机烟灰中的甲苯/甲醇(1:1)或二氯甲烷的分析方法。总体而言,迄今为止用于生物炭或生物炭相关材料中PAH测定的分析方法是高度不同的。鉴于上述情况,私人实验室通常采用的几种官方方法(例如,使用环己烷的ISO 38 414,使用石油醚的DIN EN 15527)也可能无法定量地测定生物炭中的PAH。这将对生物炭质量的优化产生影响,从生物炭登记和立法的角度来看是有问题的,并且可能导致生物炭接收基质中不必要和不受控制的高PAH暴露。因此,本研究的目的是提供一种简单而有效的方法,从研究人员,从业人员和立法者那里定量提取美国环保署从生物炭中定义的16种多环芳烃。该方法在溶剂组成,提取技术和持续时间以及提取物净化方面进行了优化,使用一系列不同的代表性生物炭样品。作为起点,使用甲苯是因为(1)DIN ISO13877规定高度污染的土壤最好用甲苯提取,(2)Jonker和Koelmans[4]用甲苯作为木炭得到最好的结果,验证包括品质因数,如绝对和相对回收率,精密度和方法检测限。最后,从生物炭质量,立法和土壤保护的角度讨论了获得的定量结果的相关性。
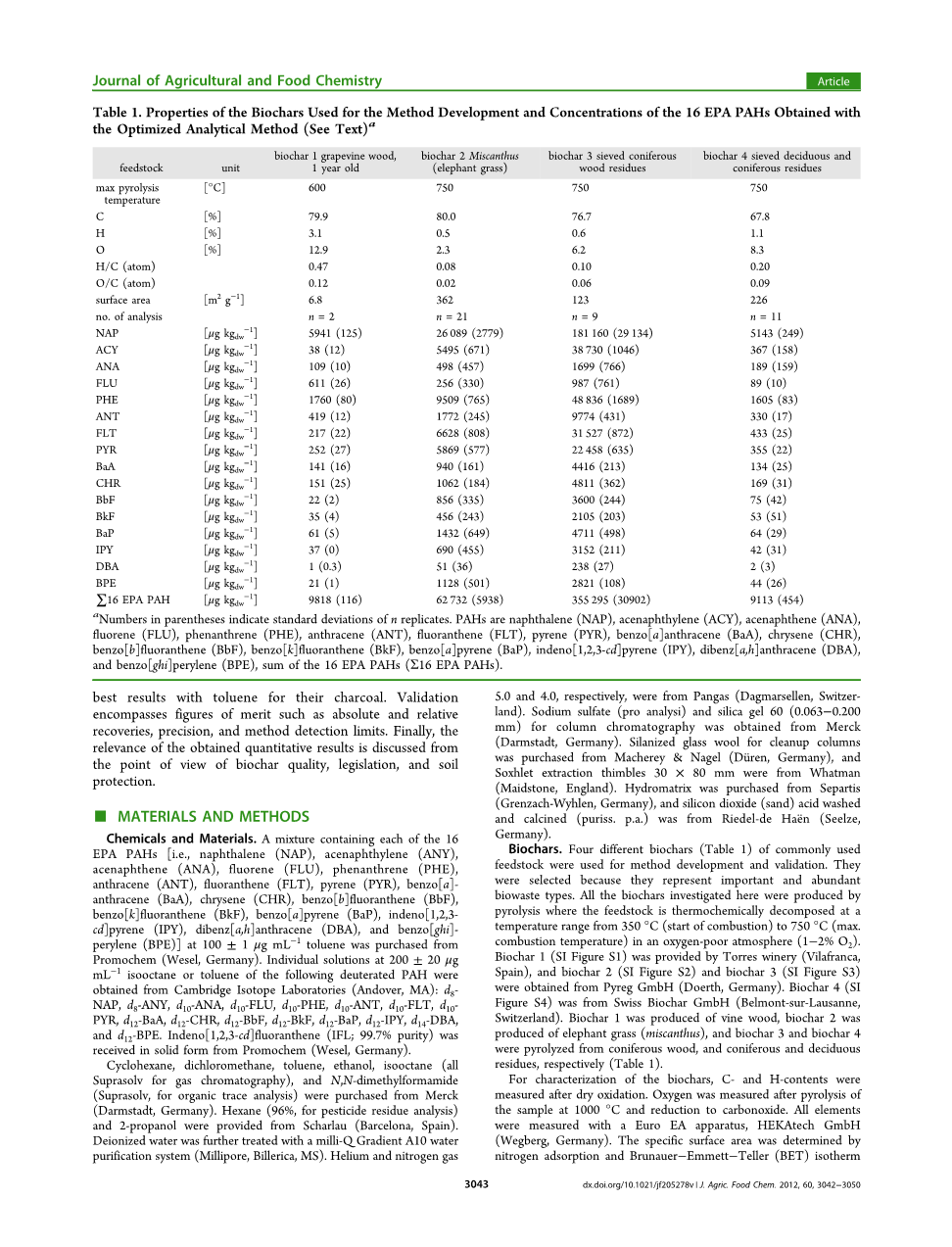
表1.用于方法开发的生物炭的性质和使用优化分析方法获得的16种EPA PAH的浓度(参见文本)
括号中的数字表示n个重复的标准偏差。 PAHs是萘(NAP),苊烯(ACY),苊(ANA),芴(FLU),菲(PHE),蒽(ANT),荧蒽(FLT),芘(PYR),苯并[a]蒽(BaA) ,䓛(CHR),苯并[b]荧蒽(BbF),苯并[k]荧蒽(BkF),苯并[a]芘(BaP),茚并[1,2,3-cd]芘(IPY),二苯并[ a,h]蒽(DBA)和苯并[ghi]苝(BPE),16种EPA PAHs(Sigma;16EPAPAHs)的总和。
材料和方法
化学品和材料。含有16种EPA多环芳烃[即萘(NAP),苊烯(ANY),苊(ANA),芴(FLU),菲(PHE),蒽(ANT),荧蒽(FLT),芘(PYR)的混合物),苯并[a]蒽(BaA),䓛(CHR),苯并[b]荧蒽(BbF),苯并[k]荧蒽(BkF),苯并[a]芘(BaP),茚并[1,2,3-cd]芘(IPY),在100plusmn;1mu;g/ mL 甲苯中的二苯并[a,h]蒽(DBA)和苯并[ghi] 苝(BPE)]购自Promochem(Wesel,Germany) 。在200plusmn;20mu;g/ mL 异辛烷或下列氘代PAH的甲苯中的单独溶液是从Cambridge Isotope Laboratories(Andover,MA)获得:d8-NAP,d8-ANY,d10-ANA,d10-FLU,d10-PHE,d10-ANT,d10-FLT,d10-PYR,d12-BaA,d12-CHR ,d12-BbF,d12-BkF,d12-BaP,d12-IPY,d14-DBA和d12-BPE。来自Promochem(Wesel,Germany)的固体形式的Indeno [1,2,3-cd]荧蒽(IFL; 99.7%纯度)。环己烷,二氯甲烷,甲苯,乙醇,异辛烷(所有Suprasolv用于气相色谱)和N ,N-二甲基甲酰胺(Suprasolv,用于有机痕量分析)购自Merck(Darmstadt,Germany)。从Scharlau(西班牙巴塞罗那)提供己烷(96%,用于农药残留分析)和2-丙醇。用milli-Q Gradient A10水纯化系统(Millipore,Billerica,MS)进一步处理去离子水。氦气和氮气5.0和4.0分别来自Pangas(Dagmarsellen,Switzer?land)。用于柱色谱的硫酸钠(pro analysi)和硅胶60(0.063-0.200mm)得自Merck(Darmstadt,Germany)。用于净化柱的硅烷化玻璃棉购自Macherey&Nagel(Duuml;ren,Germany),并且Soxhlet提取套管30times;80mm来自Whatman(Maidstone,England)。 Hydromatrix购自Separtis(德国Grenzach-Wyhlen),二氧化硅(砂)酸洗和煅烧(puriss.p.a。)来自Riedel-deHaeuml;n(Seelze,德国).
生物炭。 常用原料的四种不同生物炭(表1)用于方法开发和验证。 选择它们是因为它们代表了重要且丰富的生物废物类型。 这里研究的所有生物炭都是通过热解产生的,其中原料在贫氧气氛(1-2%O2)中在350℃(燃烧开始)至750℃(最高燃烧温度)的温度范围内热化学分解.生物质炭 1(SI图S1)由Torres酒厂(西班牙Vilafranca)提供,生物炭2(SI图S2)和生物炭3(SI图S3)从Pyreg GmbH(Doerth,Germany)获得。 生物炭 4(SI图S4)来自Swiss Biochar GmbH(瑞士洛桑贝尔蒙特)。 生物炭1由藤本植物生产,生物炭2由大象草(芒草)生产,生物炭3和生物炭4由针叶木,针叶林和落叶松生产,残留物(表1)。
为了表征生物炭,在干氧化后测量C-和H-含量。 在1000℃下热解样品并还原成氧化碳后测量氧气。 所有元件均用Euro EA设备HEKAtech GmbH(Wegberg,Germany)测量。 比表面积通过氮吸附和Brunauer-Emmett-Teller(BET)等温线与Quantachrome Instruments(Odelzhausen,Germany)的NOVA 2e测定。
样品制备和提取。 首先将所有生物炭在40℃下干燥过夜,然后用切割机SM1 Retsch GmbH(Haan,Germany)研磨至0.75mm。 另外,一些研磨的生物炭在0.25mm处筛分,而其他的也从0.75mm的馏分中研磨。 所有生物炭在干燥的地方和室温下储存在琥珀色玻璃中。 在提取之前,将样品与Turbula振荡器 - 混合器Bachofen AG(Muttenz,Switzerland)充分混合。 将等分试样放入105℃的烘箱中4小时,以确定生物炭的干重。
对于使用索氏提取的方法开发,测试了不同的溶剂和提取持续时间。 使用100%甲苯作为起始溶剂4并与几种混合物比较,即甲苯/甲醇(1:6,v / v;最适合木炭,根据参考文献4),二氯甲烷/丙酮(1:1,v / v; Dionex应用说明中推荐的溶剂,见下文),甲苯/乙醇(2:1,v / v),甲苯/丙醇(2:1,v / v),甲苯/己烷(2:1,v / v),甲苯/庚烷(2:1,v / v)和甲苯/二氯甲烷(2:1,v / v)。 还测试了Fernandes和Brooks7使用的己烷(100%)和庚烷(100%)作为替代提取溶剂[4],提取时间为15或36小时,样本量为1或0.1克(见下文)。
使用来自Dionex GmbH(Idstein,Germany)的加速溶剂萃取器(ASE 200)将索氏提取与加速溶剂萃取进行比较。 11mL ASE细胞用水基质填充一半。 然后,将1g生物炭填充到电池中,并且剩余的空间填充有水基质。 提取程序基于ASE Dionex应用说明313,用于土壤和沉积物中的PAHs。 其中,萃取参数设定如下:温度100℃,样品重量1-10g,压力2000psi(13.79MPa),预热5分钟,静态(萃取)时间5分钟,萃取溶剂二氯甲烷/丙酮(1: 1,v / v),冲洗量60%,用氮气吹扫1MPa,持续60s。 另外,还测试了1500psi的压力以及100%的甲苯和甲苯/甲醇(1:6,v / v)。 此外,静态循环进行两次。 一个样品的总提取时间为20分钟,提取物体积为约22mL。
样品清理。 根据Bucheli等人的方法进行PAH的样品净化[10]。简而言之,索氏提取物,其中每一种都加入1mL异辛烷作为保持剂,浓缩使用来自Buuml;chi(Flawil,瑞士)的Syncore Analyst系统,用二甲基甲酰胺/ Milli-Q水(9:1,v / v)液 - 液分配和超过10% - 水失活的硅胶清洗。 与参考方法相反,其中取出25%浓缩提取物的等分试样,所有1mL浓缩物用于清洁。为了测试该方法的稳健性,省略了所述清洁步骤中的第二个或两个 ,评估了提取物清洁度对量化的影响。
多环芳烃的分离和GC-MS测定。如Bucheli等人所述进行PAH分析。简言之,通过在柱上注射1mu;L提取物,在Agilent GC 6890N上分离PAH。在Restek(Bellefonte,PA)的Rtx-5Sil MS毛细管柱(30mu;m,内径0.25mm(i.d。),0.25mu;m膜厚度)上进行分离。作为保留间隙,在分离柱之前安装来自同一供应商的2 m Siltek保护柱(0.53 mm i.d.)。氦气以1mL / min的恒定流速用作载气。喷油器温度设定为烤箱跟踪模式(始终高于烤箱温度3°C),和烘箱温度如下编程:在100℃下1分钟,在5℃下1/min 下至300℃,在300℃下15分钟。使用Agilent MS 5973i在电子轰击模式下进行检测,具有70eV电离能和单离子监测。识别给定的通过使用两种化合物特异性离子来确保分析物,所述离子的质量比与通过内部校准确定的质量比相似。对于所有PAH(包括IFL)和所有氘代内标,定量离子对应于相应的分子量(m / z =M ·)对于所有PAH,定性离子为[M-2H] ,对于内标,定性离子为[M -2D] 。使用内标法进行定量。使用含有不同量的分析物(7.5-2500pg /mu;L)和恒定量的内部(和回收)标准物(200pg /mu;L)的甲苯混合物进行校准。
方法验证。对16种EPA PAH中的每一种确定的分析品质因数是绝对和相对回收率,方法精密度,检测限(LoD),空白浓度和线性。通过将提取前添加的氘代内标(替代标准品)与样品分析前添加的回收标准(IFL)相关联,与校准溶剂中的相同比例相比,对常规回收率(也称为替代物回收率;百分比)进行常规定量。绝对回收描述了分离/检测过程中分析物损失导致的分析物损失。为了确定相对回收率(加标回收率),在提取之前将1000或2000mu;g/kg的每种PAH掺入生物炭中。通过将每个分析物的定量减去天然量(均用内标法测定)除以其添加量来获得回收率,并且还以百分比给出。相对回收率反映了氘代内标的适用性,以补偿分析过程中的分析物损失,并描述了分析过程的稳健性。回收分析一式三份进行。获得精确度作为分别用
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[19236],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



