
英语原文共 15 页,剩余内容已隐藏,支付完成后下载完整资料
免疫侵袭:炎症反应在阿尔兹海默症病中的地位
摘要
过去二十年对于阿尔兹海默症的病理研究很大程度上是基于淀粉样级联假说;与阿尔兹海默症相关的神经炎症反应被认为只是由阿尔兹海默病病理生物学反应。但是,临床前和临床研究的新数据表明免疫系统介导的活动才是导致和驱动AD病理的真正原因。这些见解已经暗示了对于阿尔兹海默病新的潜在治疗方法,包括小胺质细胞和几种细胞因子。此外,不像多发性硬化和胺炎这样典型的神经炎症疾病,阿尔兹海默病中的炎症反应主要涉及固有的免疫系统。在阿尔兹海默病中,神经炎症反应的概念可能需要重新定义。
正文:痴呆是危及我们后代的暴露于全球公众面前的健康挑战:全球超过3500万人染上了这一疾病,在2010年,用于治疗痴呆的全球财政超过60000亿美元。痴呆的最流行原因是阿尔兹海默病,这一病症是致命的神经退行性紊乱,伴随有渐进性意识和功能损伤和记忆缺失。许多案例表明阿尔兹海默病具有晚发性和零星性,并不具有孟德尔遗传规律,这一疾病的流行激发了人们对于生活的期待,它影响了年龄超过90岁三分之一以上的人群。没有有效手段治疗和遏制阿尔兹海默病的产生;目前的药物治疗只能温和地、暂时地缓和病症。对于早期疾病诊断的有效生物标记物也不存在。
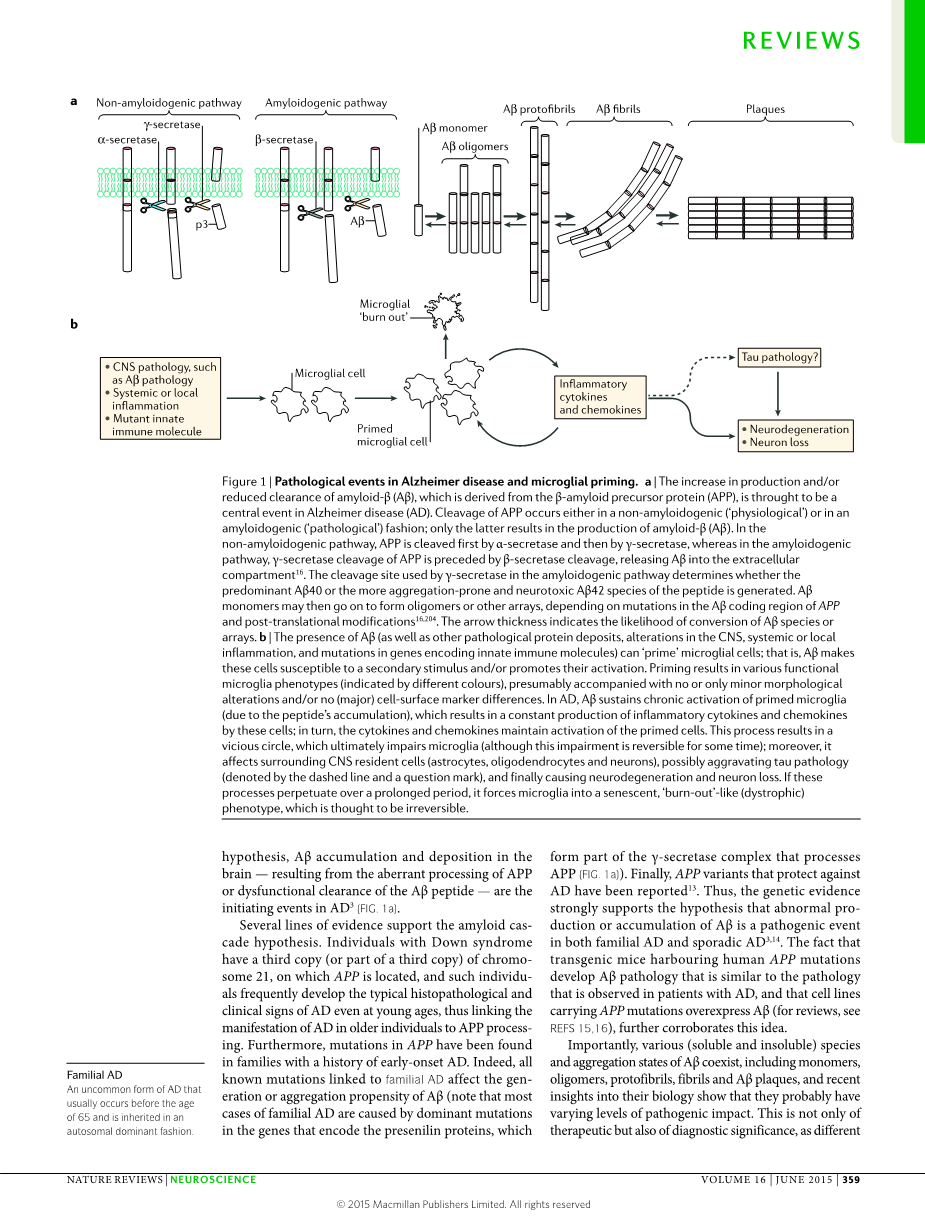
淀粉样级联假说是过去几十年里面阿尔兹海默病领域主要的致病理论。它阐明导致阿尔兹海默病的病理学事件、顺序,首先是beta;淀粉样多肽的聚糖,紧接着是神经纡缠到缠沉淀。神经纡缠缠结是由微管相关的tau蛋白组成,最后开始出现突触和神经的功能失常和损伤。
炎症反应也是阿尔兹海默病的病理学特征之一,大脑内的脊髓细胞推动炎症反应。超过十年,已经有数据表明免疫系统在阿尔兹海默病中的作用;但是,炎症反应被对于阿尔兹海默病致病性的重要性直到最近才被领会,现在,炎症反应被认为是导致和加速阿尔兹海默病。我们提出一个在阿尔兹海默病发病机制只对于炎症反应作用更好的理解传达出一种新的治疗靶向和分诊断相关的生物标记。
这篇文章的主要目的是回顾免疫系统对于阿尔兹海默病发病机制的最新知识。首先我们总结了阿尔兹海默病现行的一致观点,然后将免疫行为和阿尔兹海默病现有知识进行整合,最后,在阿尔兹海默病中,通过特异反应细胞,细胞产物和细胞信号通路,这一通路与阿尔兹海默病相关,没有任何关于这些免疫行为是有害还是有益的预想,我们定义了神经炎症的概念。这些与免疫相关的新奇观点拓宽了我们对于阿尔兹海默病发病机制的全面理解,最重要的是可能导致控制疾病进程治疗方法的产生。
淀粉样级联假说
阿尔兹海默病中两个基本的病理学特征是Abeta;老年斑个神经纡缠缠结(NFTs),老年斑是Abeta;的胞外沉淀(Abeta;来自于淀粉样前体蛋白App的水解,神经纡缠缠结(NFTs)主要是由过度磷酸化的Tau蛋白组成。)虽然阿尔兹海默病的病理生理学还不为人知,但是很多证据表明Abeta;和Tau蛋白是导致疾病进展的主要原因。的确,根据淀粉样级联假说,大脑中Abeta;积累和沉淀——是AD的最初原因。
几个证据支持淀粉样级联假说。患有唐氏综合征的人有三条21号综合染色体,App又位于21号染色体上。在年轻的时候,这些人频繁的发展为典型组织病理学和诊断标记特征的加工相关。而且,APP相关基因突变已经在早发型AD家族中被发现。的确,所有与FAD相关的已知的基因突变影响Abeta;的生成和Abeta;混合的性质(注意:大多数FAD案例是由基因中起主导作用的突变造成的,这些基因编码早老素蛋白,早老素蛋白是r-分泌酶混合物的一部分)。最后,预防AD的APP变体已经被报道。因此,基因证据强烈的支持这个假说,即,Abeta;不正常的产物和积累是家族性的暂时的阿尔兹海默病的病理学原因。携带有人类APP突变的转基因小鼠产生了Abeta;病理学,这一病理学是与在病人中观察到的病理学相似,以及携带有APP突变基因的细胞系过度表达Abeta;,进一步印证了这一想法。
重要地,各种可溶和不可溶的Abeta;共存的种类和聚集状态,包括单体,寡聚体、原纡缠、纡缠和Abeta;老年斑,以及最近在生物方面的观点表明他们存在不同水平的致病性影响。这不仅对治疗也对诊断具有意义,正如Abeta;种类的不同,至少通过现行的诊断方法不能做出等效的检测。所以,Abeta;老年斑,即在大脑AD阿尔兹海默病方面被用作神经病理检测的物质。只是Abeta;呈现的很多方式中的一种,也不一定是与认知下降这样的AD诊断信号相关,至于其他方面,跟相关的Abeta;种类任然不为人知。
引起疾病的Abeta;势不可挡的证据——或者至少是某些种类的Abeta;——已经激发设计干涉策略去清除过量的Abeta;,防止其形成或删除它。这种对Abeta;的特别关注在某种程度上可以解释人们对除APP和Tau蛋白研究以外相关研究的忽视,并认为其与致病性无关。 这也解释了为什么在AD中的免疫系统相关的事件,最近才成为致病性的一个中心话题,并最终可能与治疗相关。有人提出,原先的淀粉样级联假说应略作修改,将一个更重要的角色,即Tau蛋白和炎症反应整合进去,以更好的解释和完善这一假说。
阿尔兹海默病中会发生神经炎症反应吗
神经炎症反应被认为是只发生在AD的晚期阶段也可能仅仅是一种假象。特别的,神经胶质细胞激活被认为是伴随产生的,但是不会显著地导致淀粉样病变。但是,在阿尔兹海默病中,神经胶质细胞的活动范围和其他免疫相关的改变仍然没有被仔细分析 和被很好的理解。
最近,临床前的数据,基因数据和生物信息学数据已经显示免疫系统的激活会伴随有AD病变和导致疾病的产生。在众所周知的的阿尔兹海默病的调查案例中,基因导致了这种行为,却忽视了其他联系。AD与基因突变之间的具体联系从概念上已经得到了改变,免疫作用与AD发病机制第一次被提出,超出了纯粹的描述水平。基因编码免疫系统分子的危险变体的发现,促进了对之前报道调查的重新评价,这些调查时关于炎症细胞因子,炎症趋化因子素和其他的免疫介质的水平在个体的体液和组织中被增加,这些个体患有AD或者AD的前驱症状。
最近的研究不仅证实免疫系统分子、路径和基因方面各种各样的改变。也改变了在这个疾病进程中对于免疫系统变化时间调整的了解。根据淀粉样级联假说的理论,免疫系统激活有Abeta;的沉淀生成,这一过程主要是通过正如小胶质细胞和星型胶质细胞这样的神经胶质细胞所介导。但是,临床特征的相关性分析优先于AD的温和性意识损伤和炎症反应改变的症状(例如在脑脊髓液中)已经暗示了免疫系统的早期参与。而且一项研究显示在野生小鼠中通过虚拟模拟某种酸合偶发的引发和驱使包含Abeta;老年斑,Tau蛋白聚集物小胶质细胞激活和反应性胶质增生的类似AD神经病理学的产生,这一研究说明免疫行为能够加速类似AD的病理和造成AD。通过源于患有退行性CNS(中枢神经系统)疾病的病人组织中炎症反应基因的负转录调控和临床前实验方法的特异免疫分子,神经退行性疾病过程的调制也表明炎症反应与神经退行性疾病之间的联系,以及多杂的免疫行为在早期发病过程。这些结果暗示至少在某些程度上免疫过程会不依赖Abeta;沉淀和持续的Abeta;含量的增加驱使AD病因,从而加剧病理学和最终恶性病理生理周期。
神经炎症反应能够被中枢神经系统固有因素和中枢神经系统以外的系统因素诱导。系统炎症反应可能会导致严重的疾病,例如牛皮癣,最近研究显示牛皮癣与痴呆恶化之间的关系,或者肥胖和子型糖尿病,在肥胖和子型糖尿病中,中枢神经系统炎症反应和小胶质细胞激活已经被作为重要的成分。固有的中枢神经系统神经炎症反应(例如外伤性脑损伤和蓝斑的退化)也会促进AD病理的发展。
定义神经炎症反应
在阿尔兹海默病中观察到的免疫系统激活通常被标以“神经炎症反应”。我们知道实际上免疫系统没有参与中枢神经系统的紊乱。在所以组织内,免疫系统对于病理的改变是很敏感的,这一点为大家广泛接受。特别的,组织中特有的免疫细胞感受组织中的变化,通过叫做损伤相关分子模型(DNMPs),在阿尔兹海默病中,这一模型包含错误折叠蛋白和淀粉样蛋白。传统的神经炎症反应疾病(例如多发性硬化和脑炎)的定义是有别于神经退行性疾病(例如AD和PD)。例如适应性免疫系统的血源性白细胞的组织入侵——即T和B淋巴细胞——是MS(多发性硬化)和脑炎的突出特点。但是就我们知道的这些特征不是AD和PD的显著特征。的确,阿尔兹海默病中的炎症反应主要是与中枢神经系统固有的免疫细胞相关——即小胶质细胞,血管周围的髓细胞和其他的活化分子,例如星型胶质细胞。无关性的持续讨论神经炎症反应不仅有治病相关特征也是神经性紊乱的最初疾病源,正如AD这样的中枢神经系统退行性疾病中,小胶质细胞和星型胶质细胞的作用导致AD的发生和AD病理的伴随部分。相反,传统神经炎症反应疾病(多发性硬化和脑炎)的免疫激活是被疾病激活的。
我们提出对于炎症反应的本质特征可以用来区分传统意义的神经炎症反应疾病和神经退行性紊乱;更确切的说,区分方法在于病理过程是被主要的适应性免疫细胞(正如我们见到的脑炎)还是被中枢神经系统固有的溶血性免疫细胞驱动。此外,通过固有免疫成分和适应性免疫成分的不同性质,我们能够较好的鉴别中枢神经系统疾病。这些区别暗示我们可以通过集中免疫系统的各方面的特征来促进治疗发展,从那些缺乏神经炎症反应的免疫体中分离中枢神经系统紊乱物对于病人和科学家而言是毫无意义的。关于治疗,无论免疫贡献是第一类由疾病造成的还是第二类涉及疾病的发生和加剧都不是问题。
下面比较AD和MS致病性差异,第一点MS的基因表明T淋巴细胞在疾病进程中的作用,然而最近对于偶发性AD的广泛基因相关性研究发现AD和其他基因之间的关系,这些基因涉及固有免疫系统。第二点,在多发性硬化中,疾病的进程始于T细胞自身免疫,这一过程在信息化动物模拟中得到证实,然而在AD中的疾病进程始于不正常蛋白的加工和扭曲的固有免疫系统。第三点,交织在AD中的数量性基因座是在单核细胞中表达的,而同样的过程在MS中是发生在T淋巴细胞中的。
阿尔兹海默病中免疫系统的激活在疾病的进程中至少起到领跑者、延续和加速的作用;虽然到目前为止,神经炎症反应不被作为疾病进展过程中的触发物,但是不能排除它的作用,至少在某种程度上,可能会在疾病初期发挥不利的作用。
阿尔兹海默病中神经炎症反应的机制
小胶质细胞促进阿尔兹海默病中的炎症反应。小胶质细胞是神经中枢系统中胚胎造血源的脊髓细胞。像大多数组织中的巨噬细胞一样,小胶质细胞巡视着大脑中的病原体已经维持中枢神经系统体内平衡和可塑性;例如通过和改变突触。小胶质细胞是用来感受正如阿尔兹海默病中的蛋白聚合体这样的危险信号以及通过一系列表态和功能属性对神经健康作出反应。
在所有非中枢神经系统的细胞中,小胶质细胞是与阿尔兹海默病组织改变最亲切相关的细胞。从患阿尔兹海默病个体脑组织解剖中发现,巨噬细胞起源于小胶质细胞,也可能起源于周围浸润有Abeta;老年斑的单核细胞,实质,小胶质细胞的形态学也表明这些细胞也面临着挑战。
可溶性Abeta;低聚体和Abeta;纡缠能够连接到小胶质细胞表达的受体上,这些受体包括CD14、CD34、CD47、abbeta;1整合蛋白、A类清道夫受体、RAGE和TLRs。在体外,Abeta;连接到CD36或者TLR4受体上会使得炎症反应细胞因子和趋化因子的产生。在体内,白细胞介素-1(IL-1),IL-6,IL-12和IL-23以及TNF在阿尔兹海默病动物模型和人类大脑和中枢神经系统中的含量上升并能被检测到。在研究AD的转基因小鼠模型中,CD40和CD40L的相互作用和直接TLR4触发小胶质细胞释放TNF(肿瘤坏死因子)。
除了Abeta;能连接在其上的各种小胶质细胞受体的产生,Abeta;在体外实验中能够被小胶质细胞清除,主要通过受体介导的吞噬细胞和讲解作用。但是,这些报告的相关性还有待确定,也不清楚在体内下胶质细胞本身能够吞噬Abeta;纡缠蛋白。不过,小胶质细胞拥有去降解能够被消化的可溶性Abeta;是通过正如神经内肽酶(脑咖肽酶)和胰岛素降解酶这样的胞外蛋白酶实现的。
除了少数有远见的调查人员,许多调查者认为阿尔兹海默病中小胶质细胞具有像变形虫一样的形态学,说明由于可溶性炎症因子的刺激使得小胶质细胞病变,这种形学被错误的认为是小胶质细胞激活的标志。但是,现在有强烈的证据表明,小胶质细胞的功能是依靠于Abeta;损伤,这一理论通过玻璃粉延伸能力的下降得到证明。这些调查中的另一项研究表明患AD的转基因小鼠能够降低连接Abeta;的清道夫受体缓解Abeta;的酶。重要的,有效的吞噬作用还包括自噬途径,即贝谷兰-1,它能显著的降低AD中的小胶质细胞。小胶质细胞损伤与变形虫表型的功能之间的联系,有助于理解AD病原,特别是这一观点的提出,即,Abeta;的低效清除是保发性AD的主要病原因素。因此,瞬态损耗已经发生机能失调的小胶质细胞对患有AD病动物模型Abeta;负担没有任何影响。
自相矛盾的,TNF,IH,IL-12和IL-23这些细胞因子导致小胶质细胞的损伤。这些表明负反馈调节能够加速AD病理学。最终地,持续时间长的小胶质细胞损伤是通过营养功能的缺失和保护特征的降低完成的。小胶质细胞能够产生BDNF,BDNF能促进与学习相关突触的形态实现能动的学习,缺少功能完备的小胶质细胞会进一步影响AD过程中神经元的完整性。
Abeta;低聚体能够与神经元的细胞膜发生相互作用从而破坏神经元的功能。此外,这是很诱人的作出以下预想:AD早期阶段的小胶质细胞功能失调可能是由Abeta;造成的,因为这些疏水的淀粉样基因能够连接到任何细胞膜上。
总而言之,把小胶质细胞作为组织体内平衡的指示是很有必要的,因为小胶质细胞在健康人脑内起着十分重要的角色,小胶质细胞形态学上的改变应该被作为对于其不能正常行使功能的怀疑,小胶质细胞的完整性缺失可能造成组织病理学和中枢神经系统其他的损害。因此,AD中神经炎症反应的想法超越了在小胶质细胞形态学改变的水平,而不是暗示在细胞表型和功能方面的改变。
稀有的结构变体存在于小胶质细胞和其他的骨髓细胞中,这些变体是基因编码的免疫受体TREM2,CD33,和CR1,与高险的阿尔兹海默症有密切关联。这些调查支持了在阿尔兹海默症中小胶质细胞的功能概念的改变。 由于TREM2以前已被证明参与调节小神经胶质细胞吞噬作用,令人惊讶的是,TREM2在体内各种AD小鼠模型中的主要影响是促进活化的小神经胶质细胞及其外周衍生的骨髓细
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[138234],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



