
英语原文共 6 页,剩余内容已隐藏,支付完成后下载完整资料
利用明矾和氯化钙的化学沉淀法从水和废水中除磷
Sawsan A. M.Mohammed和Haider Abbas Shanshool
化学工程系 - 工程学院 - 巴格达大学 - 伊拉克
摘要
磷通常是内陆水域水体富营养化的限制性营养物质;因此,磷的浓度必须被控制。在目前的研究中,已经进行了一系列的烧杯实验来评估明矾和氯化钙这两种混凝剂的最适pH,剂量和性能参数。用明矾去除磷被认为是最具PH依赖性的,其最适pH为5.7-6。在该pH 条件下,80毫克/升的明矾剂量能除去83%的总磷。当溶液在PH值为6时达到较好的去除磷效率。由于这个反应进行的相对较快,因此磷的去除不受到变慢的搅拌混合时间的影响。
氯化钙的剂量和的溶液的pH值对除磷有着重要的影响。除磷效率会随着PH值得增加而增加, CaCl2的最佳剂量为60毫克/升。明矾除磷比氯化钙效果更好。
关键词:化学处理,除磷,明矾,氯化钙,水处理,废水处理
介绍
目前生活污水中的磷是植物和微生物生长的一个重要的宏观营养元素。这种营养大量排放进入天然接收源中增加了藻类的增长速率并且导致了河流富营养化(巴努等,2008)。这会反过来干扰存在于水中的生物的平衡,并影响水的质量,主要是通过藻类衰变消耗水中的氧气来实现的。水中氧含量的减少会对鱼类和其他水生生物产生有害影响,导致生物多样性减少。接受水域负载的磷排放来源有多种,它的主要来源是农业化肥的使用,生活和工业废水,以及大气沉积(普拉扎等,1997)。
除磷技术分为三大类:物理法、化学法和生物法。在生物处理厂,将磷酸盐从液中迁移到污泥中是必要的过程,但是磷的去除效率一般不会超过30%,这意味着剩余磷酸盐应当通过其它技术除去。化学沉淀法也被广泛用于除磷。将磷以磷酸钙的形式从废水中沉淀出来是除磷的重要生理化过程,并且对磷的回收变得越来越有意义。从行业的角度点来看,将磷以磷酸钙的形式回收比用其他形式更有利用价值,因为它可以作为微溶肥料在农业上实现其价值(斯尼,等人,2007)。
用于沉淀溶解态磷的药物是金属盐,如钙(Ca 2),铁(无论是铁 2或Fe 3),或铝(或明矾,Al2(SO4)3.18H2O或钠照射,Na2Al2O4)。Fe 2和Fe 3的氯化物和硫酸盐也可以被使用(德罗斯特,1997)。
用于沉淀的基本化学物质为石灰或石灰与明矾,硫酸铁,氧化镁或木炭,氯化铁结合物。通过向污水中添加石灰和明矾的来使磷得到沉淀的各种先进的污水处理技术和不同方法已经被联席会描述过多次。克肖在1911年提到在英国应用最常见的沉淀物包括:
- 石灰
- 铝铁
- 硫酸铁
- 硫酸
- Ferrozone
- 石灰,硫酸亚铁
- 石灰氯
大多数这些化学物质已被证明可以沉淀磷,并且至今都在使用(雷比茨基,1997)。自从1960年以来,对除磷研究已经做出了主要的成果(詹金斯1971)。一般来说;利用化学沉淀的除磷程度取决于许多因素,如pH,碱度,凝结剂剂量,混合的速度和其他干扰物质的影响(詹姆斯,等人,2003)。化学沉淀法或生化处理废水的絮凝研究已经被Rudolf(1947),欧文(1953),Lea(1954)等人的研究过。这些研究已经被斯塔姆(1962)讨论过。一般来说,这些调查表明,大量的磷可以通过明矾和铁絮凝或石灰沉淀去除(马尔霍特拉,等人,1964)。磷酸盐形成的化学反应是复杂的,磷酸盐形成的化学物是在磷酸盐和金属之间以及废水中的金属和配体之间形成。金属在碱性条件下形成氢氧化物沉淀的副反应是另一个考虑因素。由金属形成的常见的沉淀物以及磷酸盐沉淀的最佳pH值范围已在在表(1)给出(德罗斯特,1997)。
表(1)磷酸盐沉淀(詹金斯和hermanowicz,1991)
|
金属 |
沉淀 |
pH 范围 |
评价 |
|
Ca 2 |
各种磷酸钙 e.g.Ca3(PO4)2,Ca5(OH)(PO4)3, CaHPO4 CaCO3 |
ge; 10 le; 9.5 |
产生最低残留磷浓度,由于碳酸钙的形成水的碱度被确定。残留磷浓度范围在1-2 mg/ lit。 |
|
Fe 2 |
Fe3(PO4)2, Fex(OH)y(PO4)3, Fe(OH)2, Fe(OH)3 |
6- 8.5 |
会有一些二价铁被氧化成三价铁 |
|
Fe 3 |
Fex(OH)y(PO4)z, Fe(OH)3 |
6- 8.5 |
|
|
Al 3 |
Alx(OH)y(PO4)z. Al(OH)3 |
6- 8.5 |
|
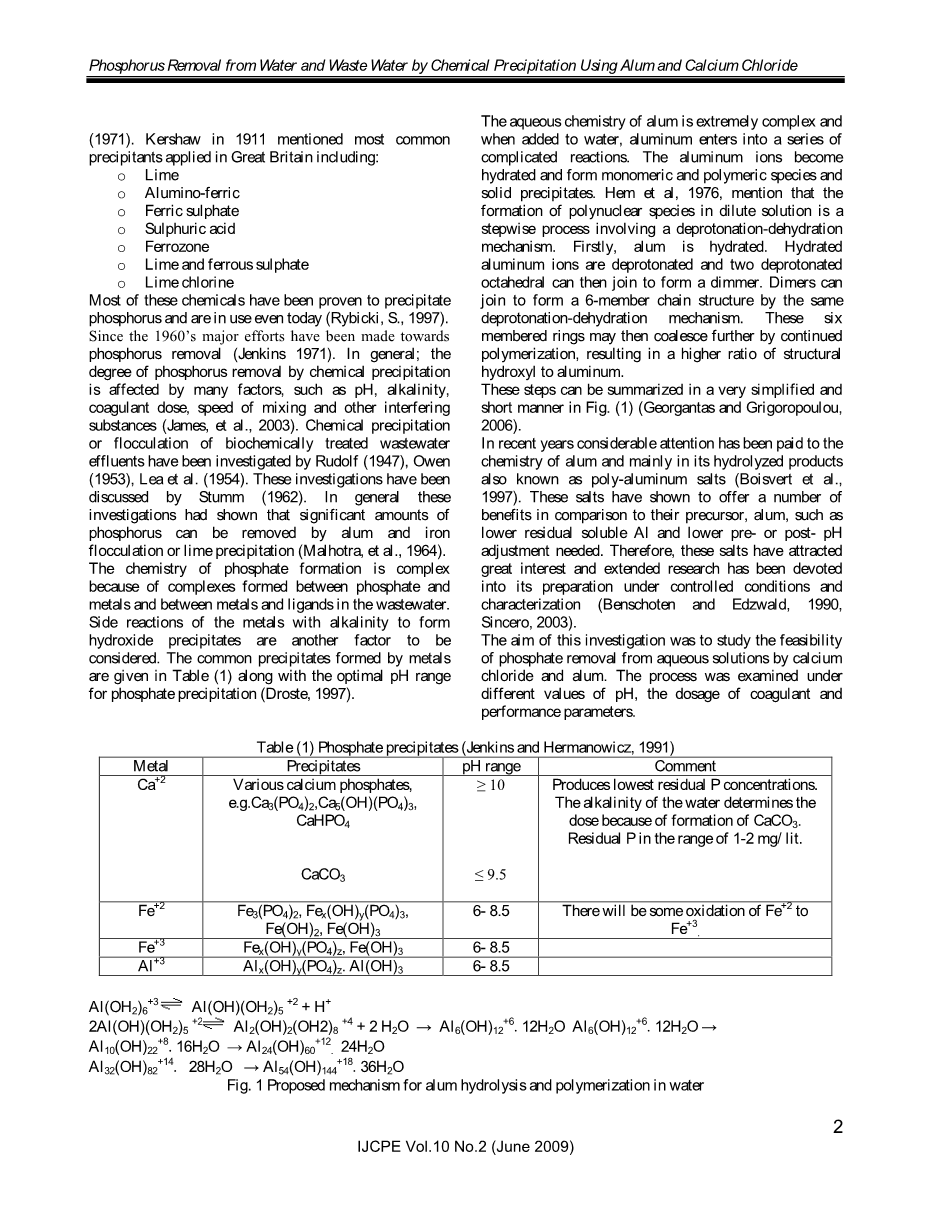
明矾的水化学是非常复杂的,当明矾加入到水中,铝产生一系列复杂的反应。铝离子与水结合发生水合反应,形成单体和聚合物质以及固体沉淀物。Hem 等人, 1976,提到多核物种在稀溶液中的形成是涉及去质子化 - 脱水机构的阶梯式过程。首先,明矾是含水的。水合铝离子是去质子化的,两个去质子化的八面体然后可以一起形成一个二聚体。二聚体可加入由相同的去质子化脱水机理形成一个六元链结构。这些六元环可以合并进一步通过不断聚合,导致结构羟基与铝的比例较高。
这些步骤可以以非常简化和简短的方式在图画(1)中总结(Georgantas和Grigoropoulou,2006)。
Al(OH2)6 3 → Al(OH)(OH2)5 2 H
2Al(OH)(OH2)5 2→Al2(OH)2(OH2)8 4 2 H2O → Al6(OH)12 6.12H2O Al6(OH)12 6.12H2O → Al10(OH)22 8.16H2O → Al24(OH)60 12. 24H2O Al32(OH)82 14. 28H2O → Al54(OH)144 18.36H2O
图1水溶液中明矾水解和聚合的机理
近年来对明矾的化学和其水解产物也称为聚铝盐上已经引起了很大量的关注(Boisvert等人,1997)。这些盐已经显示可以提供相比于它们的前体,明矾更多的好处,如较低的残余可溶性铝和较低的反应前或反应后的pH调整需求。因此,这些盐已经引起了极大的兴趣,扩展研究也一直致力于这些盐在受控条件下的制备和表征(Benschoten和Edzwald,1990年,Sincero,2003年)。
本研究的目的是研究由氯化钙和明矾从水溶液中除磷的可行性。考察了不同pH值、投加量、性能参数等。
试验工作
混凝实验是通过烧杯实验(絮凝测试仪,Zeitschaltuhr)和六联搅搅拌器在实验室室温下进行的。在每个试验中,取1升的由KH2PO4溶解制备的磷酸溶液于烧杯中。通过加入碱(1N氢氧化钠)或酸(1N HCl)将pH调节到理想的水平。混凝剂(明矾和氯化钙)在搅拌中加入。先以200转/分的速度快速搅拌1分钟,接着以30转/分的速度慢速搅拌30分钟。为探究慢速搅拌对磷去除效果的影响,实验设置了不同的时间,分别为5分钟、10分钟、15分钟、20分钟、25分钟和30分钟。沉降时间持续30分钟。
另一项实验是为了明矾的添加,通过使用几滴缓冲试剂稀释磷酸盐溶液至pH = 6。最后通过在水中溶解136克乙酸钠(CH3COONa.3H2O),加入40毫升1N乙酸并稀释至1升制备。
在沉降期后,取样品并用于pH和磷分析。pH通过一个数字的酸碱值 – 玻璃电极和饱和甘汞电极测量(奥克顿pH值2100系列由Eutech仪器,新加坡制造)。分光光度计(光谱SC,USA)用于按照标准方法分析磷酸盐(vanadomolybdo磷酸比色法)。
在Vanadomolybdo磷酸比色法这种方法中,钼酸铵与磷反应形成钼酸。在钒的存在下,形成黄色钒钼酸。黄色的强度与磷酸盐浓度成正比。
钒酸-钼酸试剂通过称(25克)钼酸铵并溶解在250毫升蒸馏水中制备溶液(A),然后将(125克)偏钒酸铵溶于200ml的蒸馏水中,再向溶液中加入(300毫升)浓HCl加入中以制备溶液(B)。将溶液A和B混合在一起,并稀释至一升,从而制成一个标准的钒钼酸盐试剂溶液。通过使用50立方厘米的容量瓶,将磷酸盐标准(KH 2 PO 4)从所述储液(1times;10 -3 M KH 2 PO 4)中制备为0.1mm,为0.2mm,0.4mm,0.6mm,作校准曲线。然后将两个样品和磷酸盐标准用于420纳米吸光度测量,同时使用钼酸铵/偏钒酸铵色试剂,方法是将25毫升稀释的样品溶液倒入50毫升容量瓶,并加入10毫升的钒酸盐 - 钼酸盐试剂,并用蒸馏水稀释。空白部分是为其中的25毫升蒸馏水被磷酸盐标准样本(Thomas和Burqess,2007)准备的。
结果与讨论
用明矾除磷
明矾用量的对除磷的影响:
Al2(SO4)3.18H2O在没有PH调节的情况下使用剂量对除磷效果的影响示于图(2)。不断增加明矾用量达80毫克/升的过程中会增加除磷量。再进一步加入明矾会导致除磷效率降低。在超过明矾的最佳剂量后随着投磷量增大,除磷效率降低的原因是由于胶态悬浮液的不稳定性(Ahmed等人,2006年)。这是由于增加剂量会使反应最适pH(5.8-6.5)转变到了不利的除磷pH范围,所以再增加剂量是没有意义的,它实际上降低了凝结剂的性能。
可溶性磷(毫克/升)
图2明矾用量对磷去除的影响
pH值对除磷的影响
以磷酸铝的形式除磷的效果的好坏高度依赖于水的pH值。将明矾加入到水中后,溶液的pH值降低。这是由于这样的事实,即一部分明矾以氢氧化物形式的沉淀,H 通过以下反应形成:
Al 3 3H2O → Al(OH)3darr; 3H
pH范围为5.5以下,铝离子是可溶性的,并且不参与使明矾作为有效凝固剂的水合和羟联反应。此外,不溶性磷酸铝根据这个方案:
Al 3 HnPO4n-3 → AlPO4 nH
形成是不可能的,因为磷酸铝可溶于pH低于 6和高于8以上的溶液(塞德拉克,1991)。另一方面,当加入明矾后,水的pH值在8以上时,铝离子又变得可溶(Al(OH)4-),导致凝聚的效率下降(Georgantas和Grigoropoulou,2006年)。 在加入混凝剂后,水的pH值比其初始pH更重要。样品初始pH对除去磷的效果影响显示如图(3)。数据包括了在pH范围为3 -11情况下总的磷去除。在这些试验中使用80毫克/升的明矾剂量和样品的初始pH通过加入NaOH(1N)或HCl(1N)调节。
可溶性磷(毫克/升)
加入明矾后的pH
图3 PH值对磷的去除效果的影响
在pH = 3时的情况下,明矾没有起到任何除磷的作用,而在pH= 6时,相比剩下的PH值,低剂量下磷去除量也很高。在pH= 6时,是因为剂量的增加导致磷的去除的降低而不是其他原因。这是由于由明矾剂量导致pH值的快速变化。在pH为8,10和11时,残留的磷在pH范围为5.7至6时减少,它类似于Georgants和Grigoropoulou(2006)和德纳姆(2007年)的结果。图(2)还表明,当溶液的PH值被缓冲液缓冲为6时,可以明显地得到较好的去除率,因为在溶液中加入明矾,PH值会快速地下降至4左右。在此pH下导致所产生的磷酸铝溶解再次释放溶解磷。与此相反,在pH= 6,磷酸铝实际上是不溶解的。
慢速搅拌时间(动力学)对除磷的影响
图(4)展示出明矾剂量为40,60和80毫克/升时慢速搅拌时间对除磷的影响。从图(4)中可以很明显的看出,除磷效果并不受慢速搅拌时间的影响。其原因可能是由于这样的事实,除磷过程是比较快的,反应一般不到5分钟就已经达到平衡。通过Szabo(2008)和Georgantas和Grigoropoulou,(2003)的实验可以观察到类似的现象。
可溶性磷(毫克/升)
时间(30转/分)
图(4):使用明矾去除磷的动力学影响
氯化钙除磷
pH值和CaCl2剂量对除磷的影响
磷去除效率的变化作为初始pH值的函数在不同氯化钙用量的影响见图(5)所示。它表明pH和氯化钙剂量对PO4-3的去除起都到了重要的作用。随着pH和CaCl2剂量的增加,除磷量增加,在pH= 11时,当CaCl 2的剂量值从40至60毫克/升时,残留的磷从5降至3毫克/升。pH值的影响可用正磷酸化合物和pH解释(即随着PH升高,经历 pH H3PO4 → H2PO4- → HPO4-2 → PO4-3的转换)(Jenkins等,1971年和斯尼。等,2007年)。然而氯化钙用量大于60毫克/升,对除磷几乎没有影响。
可溶性磷(毫克/升)
pH
图5 不同氯化钙用
剩余内容已隐藏,支付完成后下载完整资料
资料编号:[148028],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



