花色苷络合作用中分子内复制导致褪色的最新研究进展
原文作者:PauloFigueiredo,a MouradElhabiri,a KenjiroToki,b NorioSaito,c OlivierDanglesa and RaymondBrouillarda*
单位: a Laboratoire de Chimie des Polypheacute;nols, Associeacute; au CNRS, Universiteacute; Louis Pasteur, Institut de Chimie, 1, rue Blaise Pascal, 67008 Strasbourg, France
b Laboratory of Floriculture, Minami-Kyushu University, Takanabe, Miyazaki, Japan
c Chemical Laboratory, Meiji-Gakuin University, Totsuka-ku, Yokohama, Japan
摘要:从土丁桂的蓝色花和凤眼莲的蓝紫色花中提取的两种结构相似的花色苷,在弱酸性的水溶液中具有较强的稳定性。所有的色素都具有相同的生色团(飞燕草甙元),但糖基化和酰化的方式不同。此外,其中一种花色苷具有芹菜素-7-葡萄糖苷分子(一种黄酮),它是通过与丙二酸的两个酯键作用连接到糖苷链上的,而不是通过芳香酸,是已知的唯一具有这种结构的花色苷。在所有研究的分子中,除了只含有3-龙胆双糖苷(一种双糖)作为取代基的分子外,当这些分子与飞燕草甙元-3-葡萄糖苷或3,5-二葡萄糖苷分子相比时,这些分子的水合常数会降低,表明支持发色团的骨架和酰基或类黄酮基团之间存在分子内疏水相互作用。此外本研究还讨论了糖单元对色素的疏水性/亲水性作用。
关键词:凤眼莲;雨久花科;毛内旋;旋花科;分子内复制;二糖亲水效应;酰基化花青素
引言
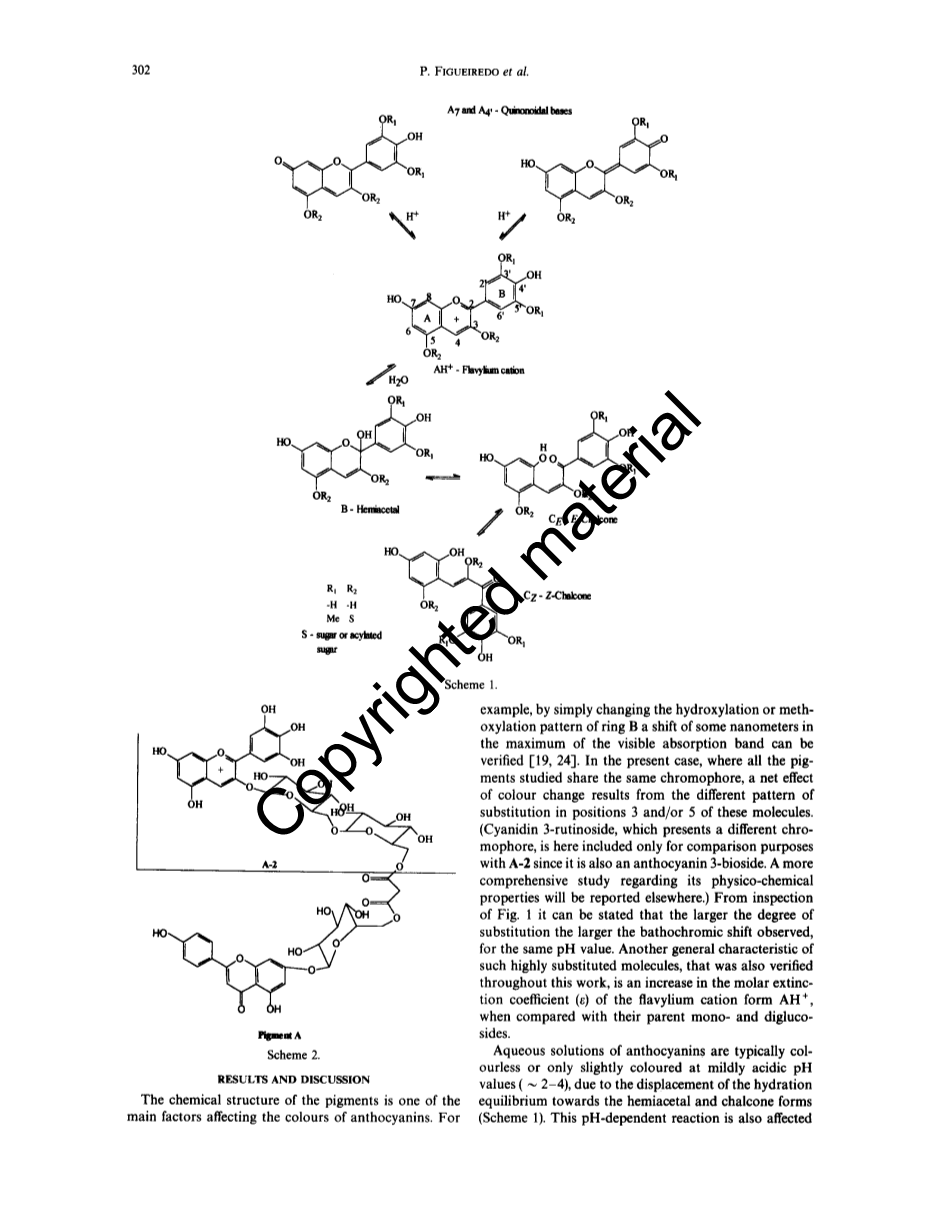
长期以来人们都知道,具有相同的显色结构的花色苷会产生不同的颜色[1,2],这取决于温度、pH值、溶剂、色素本身的结构以及其他分子(通常称为复配物)的存在等多种化学和物理因素[3],最近几年,人们发现了一组新的花色苷分子,它们具有与糖基单元相连的脂肪族和/或芳香酰基残基[4-12]。这类色素,特别是那些具有平面芳香取代基的色素,在温和的酸性溶液中具有显著的颜色稳定性,不像众所周知的单糖基和双糖基花色苷,它们在溶液中达到方案1所描述的平衡,且由于形成水合物,而在类似的条件下几乎是无色的[13-15]。因此,一些作者[2,16-18]从理论上认为酰基化分子的颜色稳定性是由芳香酰基部分在分子内复制的现象引起的,芳香酰基部分折叠并与平面吡喃环的n-系统相互作用,保护生色结构免受水的亲核攻击,这种水的亲核攻击发生在发色团的2和4两个位置[19-21]。这一假设得到了核磁共振数据的支持,这些数据证明了在芳香酰基质子和发色团质子之间存在长距离的奥弗豪塞尔核效应[22-23]。
本文报道了用光谱法测定了在弱酸性水溶液中两种花青素的热力学和动力学数据,这两种花色苷具有相同的飞燕草苷元。从凤眼莲的蓝紫色花中提取了飞燕草素-3-龙胆糖苷(A-2)和(6'-(飞燕草素-3-龙胆生物醇))(6-(芹菜素-7-葡萄糖基))丙二酸(A)(方案2)[12],还从土丁桂的蓝色花朵中提取了飞燕草素-3,5-二葡萄糖苷(B-l)、飞燕草素-3,5-二乙酰葡萄糖苷(B-2)、飞燕草素-3-对-香豆苷-5-丙二酰基葡萄糖苷(B-3)、飞燕草素-3-葡萄糖基咖啡酰葡萄糖基咖啡酰葡萄糖苷-5-葡糖苷(B-4)、飞燕草素-3-葡糖基咖啡酰葡糖基咖啡酰葡糖苷-5-丙二酰葡糖苷(B)(方案3)[13],其结构已通过1H NMR和FABMS彻底阐明[10,12]。为了进行比较,我们对飞燕素-3-葡萄糖苷和矢车菊素-3-芸香苷(也称金鱼草苷)的一些数据进行了研究。
结果和讨论
色素的化学结构是影响花色苷颜色的主要因素之一。例如,通过简单地改变环B的羟基化或甲氧基化位置,可以证实在可见光区的最大吸收峰波长发生了几纳米的位移[19,24]。在目前的情况下,所有被研究的色素都有相同的发色团,而颜色变化的净效应来自这些分子中位置3和/或5的不同取代方式(由于矢车菊素-3-芸香苷也是一种花青素-3-生物苷,因此此处仅将具有不同生色团的矢车菊素-3-芸香苷与A-2进行比较。关于其物理化学性质的更全面的研究将在其他地方报道)。从图1的检查可以看出,对于相同的酸碱度,取代度越大,观察到的红移越大。这种高度取代分子的另一个普遍特征,也在整个研究过程中得到验证,即与它们的母体单糖和二糖苷相比,2-苯基苯并吡喃阳离子(AH )摩尔消光系数(ε)会有所增加。
由于水合平衡向半缩醛和查尔酮形式转移(方案1),花色苷的水溶液通常会是无色的,或者在弱酸性pH值(~ 2-4)下只有轻微的颜色。这种受酸碱度影响的反应,还受到与苷元连接的取代基的类型和数量的影响[2,17,18,25]。当取代基的长度足以在吡喃环上形成折叠构象时,这将保护反应位点(C-2和C-4)免受水的亲核攻击,从而有利于生色结构的存在。
让我们定义以下反应来说明花青素分子在弱酸性水溶液中发生的转化:
(1)
(2)
由于B开环形成E-查尔酮的过程非常快,为了清楚起见,我们把平衡写成一个整体;CE通常由于形成的量极少[26],而常常被忽略。
此外,如果我们将水合平衡常数Kh表示为kl/k2,其中kl代表水合速率常数,k2是逆过程的速率常数,通过对分光光度数据的处理并应用如其他地方所描述的方程式(3)和(4)[18],
(3)
(4)
其中A代表花色苷溶液在给定pH下的吸光度值,A0代表AH 的吸收(pH lt; 1.0),Ka代表去质子化平衡常数,rA是摩尔吸收系数ɛA/ɛAH 的比值,k是分光光度计传递的水合反应的一级表观速率常数,我们证实了当每个系列(A和B)中花色苷由小变大时pKh值也随之增加,表1,除了呈现相反效果的色素A-2。这种有趣的行为将在后面讨论。kl值(表1)表示色素对水合的稳定性,对于B系列而言,当色素的取代基有少变多时,k1值随之降低,这与酰化程度能更有效的防止亲核攻击的假设相符。B-4的值不符合这一结论,这可以说明它的纯度较低;因此,kl值也可用于确定这类色素的纯度。在花色苷的其他系列中,值得注意的是A-2具有非常高的kl值,这与其较差的颜色稳定性一致。另一方面,飞燕草素-3-葡萄糖苷和A都具有较小的kl值,这反映了两种化合物具有高疏水性。然而,当与A相比时,发现飞燕草素-3-葡萄糖苷较低的kl值并不能反映其较高的Kh值。这可能是因为其k2值也较低,这意味着尽管其水合过程具有较小的直接速率常数,但反向作用(脱水)不如A的情况有效。
pKh增加表明存在分子内相互作用,即以无色形式为代价稳定有色阳离子形式。拥有更长和更多直线链的花色苷苷具有更强的相互作用,可能是由于连接体的不同构象之间的势能屏障较弱,使得这些花色苷具有更大的灵活性,将芳香酸的平面环(或黄酮,在A的情况下)折叠到同样平面的吡喃环上,从而通过在分子的两部分之间形成pi;-pi;疏水相互作用,这允许存在分子内络合物,AM1[27]分子轨道计算支持这一假设,尽管这些计算是在真空中进行的,因此不能直接与水溶液中的分子活动相比较,但该计算预测了折叠构象,因为热力学上更倾向于更长的结构。发色团的4和7位的酚羟基与分子中的其他部分之间形成氢键,作为分子内复制的驱动力,因为分子保留形成醌式碱基的能力,如从光谱数据(表1)获得的pKa值所示,与花色苷相比,它们没有很大变化,而似乎被排除在外。这意味着苷元的羟基应该是游离的,以便进行质子转移反应,从而形成醌类碱。这一假设与公布的一系列类似化合物的数据一致[17,18]。
然而,这种分子内缔合现象并不完全排除无色形式的形成,但是,随着pKh的值接近pKa的值,例如,化合物A的pKh值分别为2.86和3.61,这导致在更宽的pH范围内存在有色溶液,因为,与更简单的花色苷的相反,其中醌型碱快速产生半缩醛和查尔酮,在这里它们能通过分子内相互作用而更加稳定(图2)。
花色苷和花色素经历热降解,其降解速度和延伸取决于分子结构[28,29]。因此,研究分子内相互作用的形成是否对该性质有影响是重要的。我们的初步结果表明,对于最复杂的花色素苷,即A、B-3、B-4和B,至少有降低热降解速率的影响,因为在pH值大约 3.5的溶液中,在黑暗中放置约24小时,电子吸收光谱没有明显变化,而对于所研究系列中较简单的色素,结果正好相反,即可见吸收带的强度显著降低。因为查尔酮形成程度降低,这种热稳定性表明了色素折叠构象的存在。
如上所述,本试验研究的两个系列中唯一具有不同行为的分子是A-2,其在位置3上仅有龙胆苷(一种线性双糖)作为取代基。与飞燕草素-3-葡萄糖苷相比,其黄素形式的电子吸收光谱显示摩尔吸收系数(ε)值急剧下降。这与通常在花色苷复合形式中发现的小的低色移形成对比,低色移是由分子间或分子内结合产生的[3]。然而,A-2吸收系数值的大幅度下降似乎是发色团第3位具有二糖作为唯一取代基的分子的一般特征,因为在另外两种同样具有3-生物生物糖苷残基的花色苷(车菊素-3-桑布双糖苷-5-葡萄糖苷(Figueiredo,P.等人未发表的结果)和矢车菊素-3-芸香糖苷)中也证实了类似的结果。
此外,尽管与飞燕草素-3-葡糖苷相比,其pKa值没有明显变化(表1),但A-2计算的pKh值表明,相对于原分子的值,其pKh值显著降低了一个单位。这可能是由色素的特定立体化学结构引起的,其中糖部分将折叠在吡喃体系上。这种构象允许在半缩醛形式的2位羟基和第二种糖的6位游离羟基之间形成氢键。因此,在强酸性的pH值下,半缩醛形式的稳定性会优于AH ,在较温和的pH值下,半缩醛形式会比查耳酮更稳定,这一点由在pH 2.2-3.3下的吸收光谱得到证实,并且在去除黄素的影响后,没有发现查耳酮存在[30]。为了评估该模型的有效性,在真空中(AM1[27])和552个水分子的周期盒(MM [31])中对A-2和矢车菊素-3-芸香苷进行了分子力学计算,矢车菊素-3-芸香苷在其第二个糖中具有甲基端基而不是羟基。对于A-2,观察到龙胆苷以黄素或半缩醛形式向发色团折叠。获得的原子间距离值(表2)符合上述假设,因为在典型的氢键中,相邻氧原子之间的距离在2.5至3.3A范围内[32-34]。2.870A的值与糖和发色团之间存在氢键是一致的。此外,用矢车菊素-3-芸香苷进行的两种理论计算都产生了半缩醛氧与其最近邻域之间的原子间距离,大大优于通常认为能够容纳氢键的原子间距离(表2)。
通过花色素苷的半缩醛形式形成的分子内复合物也可以作为区分这种物质的两种异构体(R和S)的一种方式,因为分子必须处于其R构象才能形成氢键。计算模型实际上给出了A-2作为唯一存在的异构体的R构象(图3),以及矢车菊素3-芸香苷的S构象,该构象是最有能量优势的。
这两组天然花色苷的试验结果也证实了当与3,5-二葡糖苷[3]相比时,已知3-单葡糖苷对亲核攻击的抗性更高(表1)[3]。这种效应是由于外显异构体氧的电子密度向吡喃糖环的离域化,而导致当用beta;-D-吡喃葡萄糖氧基取代羟基时,其向吡喃环的给电子能力降低[35-37]。这种取代有望增强C-2或/和C-4的亲电特性,从而在平衡时形成更多的半缩醛。为了进一步解释这一现象,在真空中对三对3-单葡糖苷和3,5-二葡糖苷(天竺葵素、矢车菊素和飞燕草素)进行了AM1分子轨道计算。所得的结果(表3)表明,当从单糖苷变为二糖苷时,发色团C-4上的正电荷密度增加了两倍,而C-2上的电荷密度几乎保持不变。因此,我们从理
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 8 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[597740],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



