两个胰岛素受体决定褐飞虱翅型
原文作者 Hai-JunXu 1, *and Chuan-Xi Zhang
摘要:在广泛的昆虫中翅多型是一种进化成功的特征发现[1]。长翅型褐飞虱具有飞行能力,这能让他们逃离不利的生境和轨道变化的资源,而短翅型褐飞虱丧失飞行能力,但通常相比于翅型分化具有较高的繁殖力[1-3]。研究蚜虫、蟋蟀和稻飞虱显示替代翼分化发展以应对各种环境因素[1,2,4-8],而这些线索的反应可能都是通过发育激素介导的,尽管在这一领域究竟与哪些激素有关的研究已经产生了模棱两可和冲突的结果[4,8-10]。目前,昆虫的翅型分化分子机制的测定仍然遥遥无期。在这里,我们表明在迁徙褐飞虱INR1和INR2体内的两个胰岛素受体,有通过调节叉头转录因子Foxo的活性控制长翅和短翅发育的相反作用。INR1,通过磷脂酰肌醇-3-羟基激酶/蛋白激酶B(PI(3)K-Akt)信号级联诱导长翅型飞虱产生,如果这条通路被抑制,则诱导短翅型飞虱产生。与INR1相反,INR2作为INR1-PI(3)K-Akt的负调控途径:抑制这条通路诱导长翅型飞虱产生。大脑分泌的配体Ilp3诱导长翅型飞虱的产生。我们的发现提供了昆虫中首次证明翅型分化分子基础的研究,他们也是我们在替代发展成果二进制控制学科的第一个示范,因而加深我们对发展和进化的表型可塑性认识。
迁徙褐飞虱(半翅目),可发展成短翅或长翅回应环境线索(图1a补充说明1,2)。长翅褐飞虱承担完全开发前翅和后翅,而短翅褐飞虱大大减少前翅,只有小花苞般的后翅(图1b)。控制褐飞虱翅膀变种最相关的环境因素是种群密度和主要的质量[11-15]。因此我们推测褐飞虱翅型变形测定可能通过营养途径的调节。
胰岛素/类胰岛素生长因子(IGF)信号(IIS)通路是一个进化上保守的营养感应通路,调节后生动物的生长发育[16-24]。为深入了解翅型分化的IIS通路的调控,我们在第二龄若虫时进行了RNA干扰(RNAi),将胰岛素受体基因敲除。褐飞虱有两种胰岛素受体,N.lugens(Nl)InR1和NlInR2(扩展数据图1,2和补充注明3)。我们发现敲除NlInR2(dsNlInR2)与没经过处理的(对照组)褐飞虱和将靶向编码绿色荧光蛋白的基因的双链RNA(dsRNA)经过处理的褐飞虱相比,发生了强烈的偏向长翅分化(图1c)。经过dsNlInR2处理的长翅型褐飞虱保留了相同的性别比(补充表1),并在形态上和从自然长翅型没有区别(扩展数据图3a)。相比之下,敲除NlInR1处理(dsNlInR1)产生相反的反应,诱导短翅褐飞虱虫量发展(图1c)。为确保这些观测结果,我们进行了模拟实验,每个NlInR采用新的dsRNA分子,通过敲除三龄和四龄(倒数第二)若虫的两胰岛素受体,获得相同的表型(扩展数据图4a–c)。总之,这些结果表明,两种胰岛素受体的表达,NlInR1和NlInR2,与决定褐飞虱翅性分化紧密相关,并且它们在这个过程中扮演完全相反的角色。
为了更好地理解NlInR1和NlInR2如何协调规范褐飞虱翅型,我们研究了关于异翅分化发展的典型IIS途径的几个组成部分的贡献。在果蝇中,胰岛素的结合导致其受体的自身磷酸化。磷酸化受体进而诱发磷酸化的底物适配器(果蝇(Dm)Chico和DmLnk),激活PI(3)K–Akt信号级联,介导胰岛素信号的主要通路[20,21,25,26]。DmAkt磷酸化通常导致多个结果,包括DmFoxo的失活,以调节生长和增殖[27,28]。我们发现沉默NlChico或NlAkt拟表型dsNlInR1(扩展数据图3a, c和4 d)。相比之下,沉默NlFoxo或NlPten拟表型dsNlInR2(扩展数据图3a,c和4 d)。然而,我们发现在dsNlPten的褐飞虱中弧形翼发达(扩展数据图3a),很大程度上是由于NlAkt的过度磷酸化导致的[23,29]。我们的数据还显示,NlLnk可能与翅型分化无关(扩展数据图3c),这表明NlLnk或者是可有可无的,要么是NlChico功能上的补充。除了PI(3)K-Akt的信号传导级联,雷帕霉素靶蛋白复合物1(TORC1)和丝裂原活化蛋白激酶(Ras/MAPK)信号转导通路构成IIS通路的两种信号分支[16,17,19,23,30]。然而,两种信号级联参与翼型分化测定(扩展数据图5)。总的来说,我们的表型分析表明NlPI(3)K–NlAkt与NlInR1信号级联,而不是NlInR2,类似于成熟的典型IIS通路。相比之下,NlInR2似乎充当这个信号级联的负调节因子,抑制NlInR2从而导致长翅型的分化。
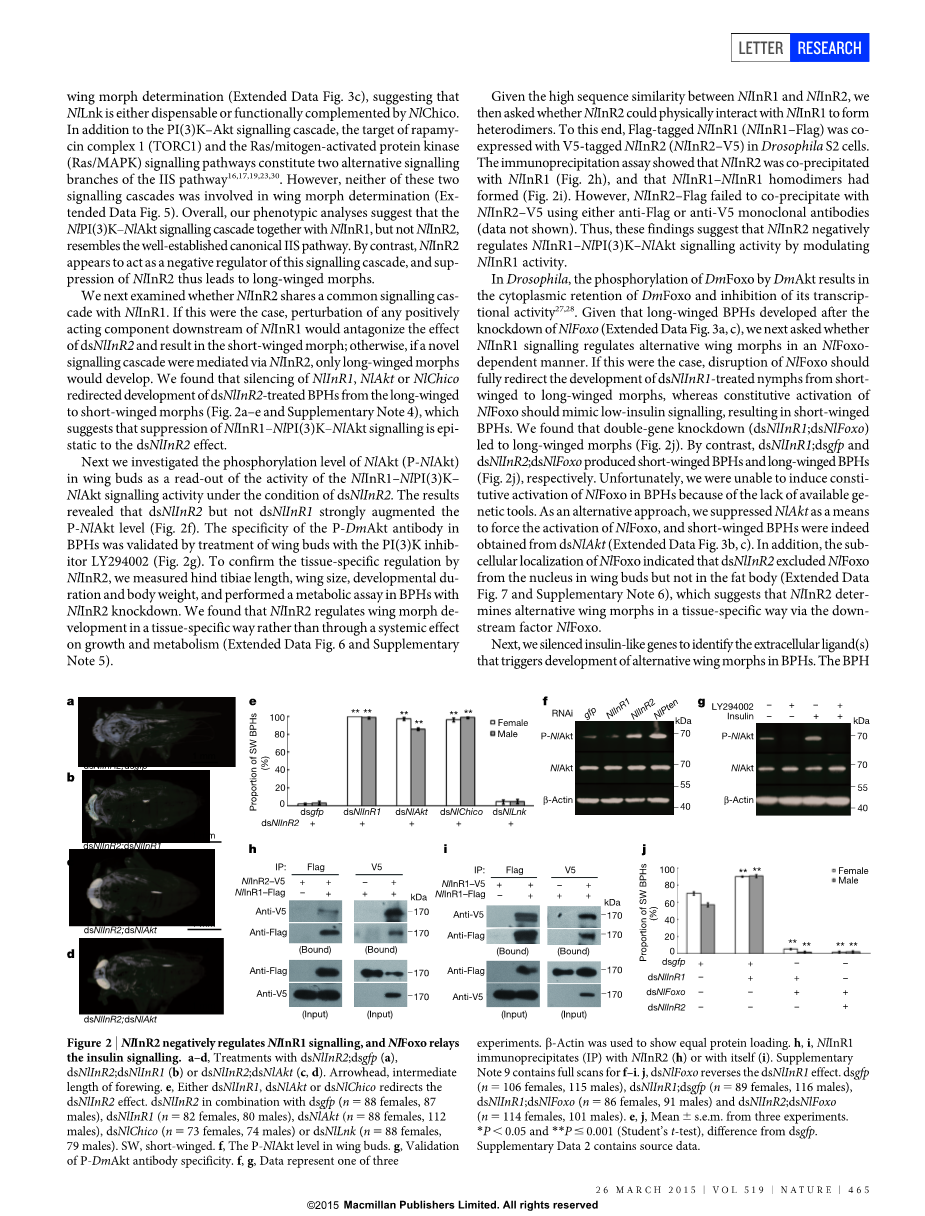
我们下一步研究NlInR2是否与NlInR1共享同一个信号级联。如果是这样的话,NlInR1下游任何积极作用的成分会扰动和对抗dsNlInR2并导致短翅分化;否则,如果一个新的信号级联反应被通过NlInR2介导,只有长翅分化能够发展。我们发现,经过dsNlInR2处理的褐飞虱沉默NlInR1,NlAkt或NlChico重新从长翅型向短翅型定向发展(图2a-e和补充注明4),这表明抑制NlInR1–NlPI(3)K–NlAkt信号传达是dsNlInR2的上位效应。
接下来我们研究了NlAkt (P-NlAkt)磷酸化水平在作为一个在dsNlInR2条件下的一个关于NlInR1–NlPI(3)K–NlAkt信号活性的读出的翅芽中。结果显示, dsNlInR2但不是dsNlInR1强烈增强了P-NlAkt的水平(图2)。褐飞虱体内的P-DmAkt抗体特异性是由用PI(3)K抑制物质LY294002处理的翅芽验证的(图2g)。通过NlInR2确认组织特异性调控,我们测量后肢胫骨长度、翅膀大小、发育历期和体重,并用敲除NlInR2的褐飞虱履行一个代谢试验。我们发现,NlInR2调节翅型分化是通过一个组织特异性的方式发展的而不是通过对生长和代谢系统的作用(扩展数据图6、补充标注5)。
鉴于NlInR1和NlInR2序列相似性高,然后我们被问是否NlInR2能够与NlInR1在物理上相互作用形成异源二聚体。为此,旗帜标记的NlInR1(NlInR1–Flag)和V5标记的NlInR2 (NlInR2–V5)在果蝇S2细胞中共表达。免疫沉淀实验表明,NlInR2是与NlInR1共沉淀的(图2h),并且NlInR1-NlInR1同二聚体已经形成(图2i)。然而,NlInR2–Flag未能与NlInR2–V5通过抗旗或抗v5的单克隆抗体沉淀(数据未显示)。因此,这些研究结果表明,NlInR2负调控NlInR1–NlPI(3)K–NlAkt信号活动通过调制NlInR1活动。
在果蝇中,DmFoxo通过DmAkt磷酸化的结果导致细胞质保留DmFoxo并抑制其转录活性[27,28]。鉴于长翅褐飞虱在敲除NlFoxo之后发达起来(扩展数据图3a、c),接下来我们疑问是否NlInR1信号调节替代翼分化以一个依赖NlFoxo的方式。如果是这样的话,破坏NlFoxo应该彻底的重定向经过dsNlInR1处理的若虫从短翅向长翅分化,而NlFoxo活化应该模仿低胰岛素信号通路,导致短翅褐飞虱。我们发现,双基因敲除(dsNlInR1;dsNlFoxo)导致长翅变种(图2j)。相比之下,dsNlInR1;dsgfp和dsNlInR2;dsNlFoxo分别产生短翅褐飞虱和长翅褐飞虱(图2j)。不幸的是,我们无法诱导褐飞虱NlFoxo的构成活化,由于缺乏可用的遗传工具。作为一个替代方法,我们以抑制NlAkt为手段,迫使NlFoxo活化,并且确实得到了短翅褐飞虱(扩展数据图3b,c)。此外,NlFoxo的亚细胞定位表明,dsNlInR2将NlFoxo从核翅芽而不是在脂肪体排除在外(扩展数据图7、补充说明6),这表明NlInR2决定替代翼分化以通过下游因子NlFoxo组织特异性的方式。
接下来,我们沉默的胰岛素基因识别胞外配体(S),触发褐飞虱替代翼分化的发展。褐飞虱有四个胰岛素/类胰岛素生长因子多肽,指定NlIlp1, NlIlp2, NlIlp3和 NlIlp4。我们发现,dsNlIlp3生成更高比例的短翅褐飞虱(图3a),有三个NlIlp蛋白有次要角色,如果有的话,在翅型“开关”(图3a,b)。值得注意的是,组织中的分布分析表明,NlIlp3主要在大脑中产生(图3c,扩展数据图8,补充视频1和补充说明7)。因为dsNlIlp3表型与NlInR1–NlPI(3)K–NlAkt信号级联的沉默效果类似,我们推测NlIlp3可能是上游配体发起此信号传导级联。如果是这样,dsNlIlp3可能重新定向dsNl R2的发展,以和dsNlInR1或dsNlAkt类似的方式。进一步,按照这个逻辑,dsNlFoxo应扭转dsNlIlp3的效果,类似于它扭转dsNlInR1的效果的方式。我们的数据显示,而dsNlInR1完全重新定向dsNlInR2表型,dsNlInR3仅部分拮抗dsNlInR2效果(图3d)。这种现象不是由于NlIlp蛋白质之间的功能冗余,而是因为沉默结合剩余NlIlp基因的NlInR3没有综合提高dsNlInR3效应(图3e)。然而我们观察到,dsNlFoxo能彻底扭转dsNlIlp3效果(图3f),这表明NlFoxo是下游NlIlp3的关键调节器。最后,我们发现,IIS通路是褐飞虱翅多型的其他家庭成员共同监管机制(扩展数据图和补充标注8)。在研究结果的基础上,我们提出了一种翅多型褐飞虱的分子调控模型(图4)。长翅分化是褐飞虱默认的发展演变,这是依赖于NlInR1–NlPI(3)K–NlAkt信号活动。然而在翅芽,对NlInR2到NlInR1妥协NlInR1信号结合,导致短翅型。NlInR3主要是上游配体触发长翅型的发展。Nlfoxo是关键下游调节因子,通过完全信任转述NlInR1信号活动确定翅型分化。
这个模型对未来的研究提出了一些重要问题在环境因素是如何转化为调节NlInR2活动的分子机制,在确切的机制中,NlInR2调节NlInR1信号活动, NlFoxo直接效应(s)的下游调节翅膀的增长,以及这两种胰岛素受体在昆虫的进化基因调控上的贡献。
方法
昆虫
褐飞虱(BPH)、白背飞虱(SFP)和灰飞虱(LSP),在这项工作中使用的褐飞虱种群最初收集于杭州(30°16′N, 120°11′E),中国,2008。雌雄褐飞虱隔离并交配产生F1代。一对被选定为同级近交繁殖13代。纯化的菌落用于两个在这项研究进行的实验中,基因组DNA测序[31]。将全部褐飞虱都放置在一个宽敞的室内26℃(plusmn;0.5℃)光周期为16:8h
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 16 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[286323],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



