姜黄素以及其他天然化合物诱导的表观遗传变化
Simone Reuter bull; Subash C. Gupta bull;
Byoungduck Park bull; Ajay Goel bull; Bharat B. Aggarwal
Cytokine Research Laboratory
摘要:表观遗传调控能在DNA序列不发生任何变化的基础上,诱导产生包括DNA甲基化、组蛋白修饰以及miRNA方面的变化,另外,表观遗传调控在膳食成分选择性地激活或抑制基因的表达上也是一个重要的机制。姜黄素(diferuloylmethane)是黄金香料姜黄的一种组成成分,近年来已经发现其能诱导表观遗传发生变化。本文总结了目前关于姜黄素调节组蛋白去乙酰化酶、组蛋白乙酰转移酶、DNA甲基转移酶I和miRNAs方面的认识,以及这些变化是如何导致基因表达修饰,除此之外,本文还涉及到一些表现出相似特性的其他保健食品。然而,姜黄素作为调控表观遗传变化的一种临床用药,还需要更深入的研究来确定新颖而有效的化学预防策略,比如说单独或与其他抗癌药物一起,以提高癌症治疗的效率。
关键词:姜黄素;表观遗传学;组蛋白乙酰转移酶;组蛋白去乙酰转移酶;DNA甲基转移酶;microRNA
- 简介
表观遗传是指在DNA序列不发生任何改变的情况下在基因表达上发生的遗传变化,是膳食成分选择性地激活或抑制基因的表达上的一个重要的机制(Davis and Ross 2007)。表观遗传机制包括DNA甲基化、组蛋白修饰以及miRNA表达方面的变化(Yoo and Jones 2006;Winter et al. 2009)。
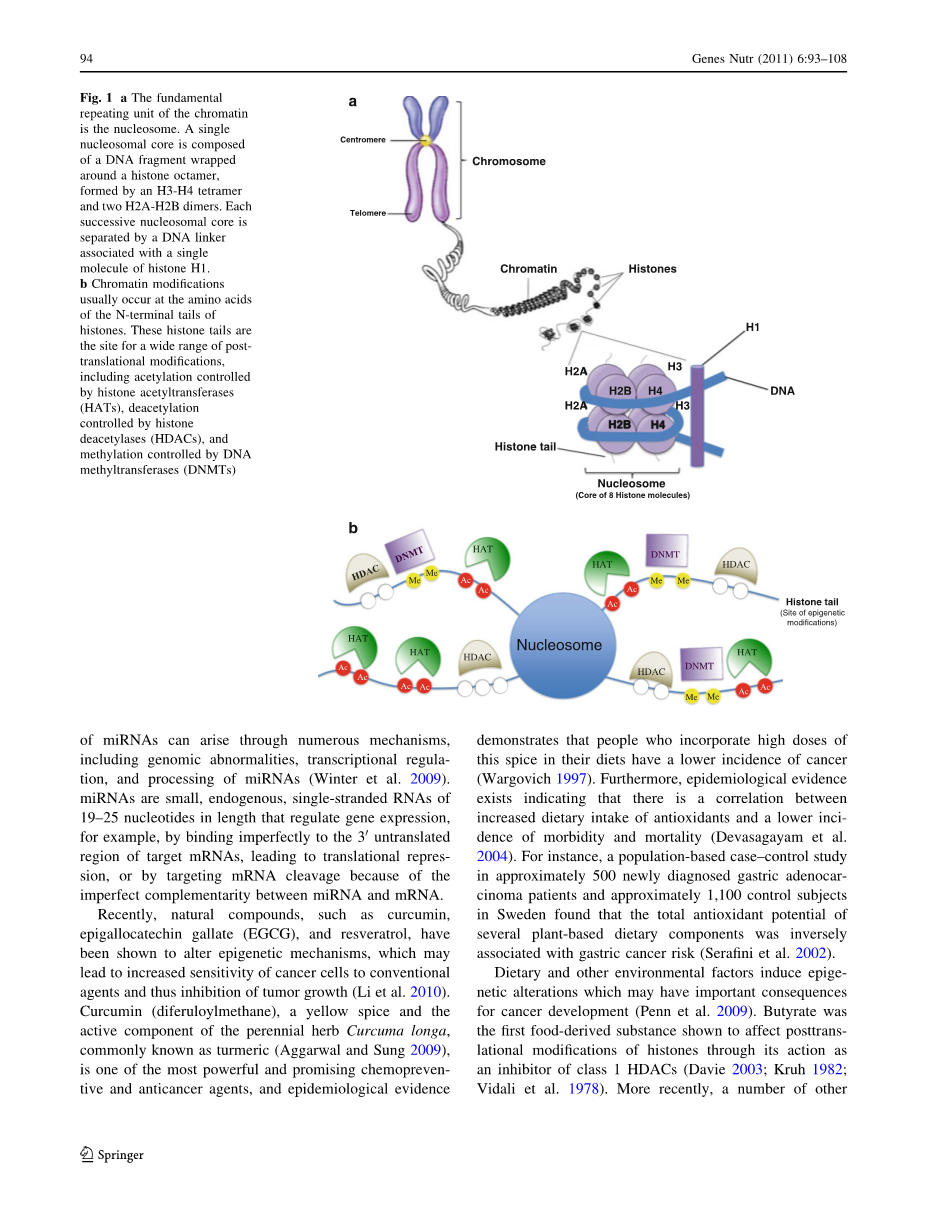
染色质结构的变化会影响基因的表达,比如当染色质封闭(异染色质)时会使基因失活,或者当染色质是开放(常染色质)时会激活基因的表达(Rodenhiser and Mann 2006)。核小体是染色质的基本重复单元,由包裹着一个组蛋白八聚体的DNA组成,这个组蛋白八聚体由4个组蛋白伴侣组成,其中包括一个H3-H4三联体和两个H2A-H2B二聚体。每个连续的核小体核心之间都被一个携带着单个组蛋白H1的脱氧核糖核酸所分隔。染色质的修饰通常发生在组蛋白中的氨基酸的N-末端,以促进或者抑制DNA修复蛋白和转录因子与染色质的结合。这些核组蛋白进行广泛的转录后修饰,包括由组蛋白乙酰转移酶(HATs)决定的与基因表达有关的乙酰化(Zhang and Dent 2005);由组蛋白去乙酰化酶决定的与基因失活有关的去乙酰化;还包括甲基化、磷酸化、泛素化、SUMO化修饰、ADP-核糖基化,还有可能包括生物素化(Davis and Ross 2007)。
除此之外,表观遗传因子也能影响miRNAs的表达。有研究发现,通过多种机制能加强miRNAs的异常表达,比如基因组的异常、转录调控过程以及miRNAs的加工过程(Winter et al. 2009)。其中miRNAs是小的内源性的由19-25个核苷酸组成的单链RNAs,它能调节基因的表达,比如说能与靶mRNAs的3rsquo;非翻译区不完全结合从而抑制转录的进行,或者能通过与其靶mRNA结合以达到切割靶mRNA的目的。
近年来,像姜黄素、表没食子儿茶素没食子酸酯(EGCG)和白藜芦醇等天然化合物已经显示能够改变表观遗传机制,这可能导致增强癌细胞对传统药物的敏感性,并因此可以抑制肿瘤的生长(Li et al. 2010)。姜黄素(diferuloylmethane)是一种黄色的香料,也是多年生草本植物姜黄的活性成分(Aggarwal and Sung 2009),是最有效也是最有前途的一种化学预防抗癌药,流行病学证据显示那些吸收高剂量的这种香料在他们的饮食中的人们,其肿瘤发生率一般较低(Wargovich 1997)。流行病学证据更深入的研究指出抗氧化及膳食的摄入量的增加与发病率和死亡率的下降存在相关关系(Devasagayam et al. 2004)。例如,一个在瑞典的以人群为基础的病例对照研究,其中包括大约500个刚诊断出胃癌的病人和与之相对应的大约1100个对照组,研究发现几种植物性饮食成分的总的抗氧化能力与患胃癌的风险成反比(Serafini et al. 2002)。
饮食和环境因素诱导的表观遗传变化可能会获得关于肿瘤发展上的重要结论(Penn et al. 2009)。丁酸盐是第一种被发现的能通过抑制class 1 HDACs从而影响组蛋白的翻译后修饰的食物衍生物质((Davie 2003; Kruh 1982;Vidali et al. 1978)。最近,一些膳食成分已经被鉴定出能调节组蛋白的乙酰化状态或影响HDACs和组蛋白乙酰转移酶的活性(reviewed by Delage and Dashwood (2008))。研究发现,在怀孕期间遭受饥荒的妇女所产生的后代,其成年后所表现的表观遗传标记显示食物缺乏可能会产生终生的影响。在那些约60岁的预先设想过的遭受过1944-1945年荷兰饥饿的冬天的成年人体内,其印记基因胰岛素样生长因子2的甲基化水平更低(Heijmans et al. 2008)。由于膳食化合物在延长寿命和减少甚至排出与年龄相关的会导致癌症的疾病上的显而易见的作用,例如白藜芦醇激活class III HDACs(sirtuins),人们对其的兴趣正在逐渐增加。
姜黄素运用它的这种有效的抗癌功效的多种机制已经被发现以及被彻底地调查了。虽然目前在药物代谢动力学上的研究发现姜黄素在人体内血浆中的浓度比细胞中的低,但数个临床前报告已经显示姜黄素确实具有抗肿瘤功效(Sharma et al. 2004; Cheng et al. 2001)。一种解释是因为它在人体内的活性,甚至处于低浓度时的活性,可能正能使姜黄素通过表观遗传调控来发挥它的生物学功能。
二、 姜黄素在组蛋白乙酰化/去乙酰化方面的影响
组蛋白修饰是表观遗传变化中最重要的,因为它能改变基因表达和癌症风险(Gibbons 2005)。HATs和HDACs的异常活性与肿瘤的发病机制有关。HDACs是一种酶,它能将乙酰基从赖氨酸的e-N-乙酰转移到组蛋白上,它的作用于HATs相反。HDAC不和DNA直接结合,而是通过多蛋白复合物(包括共抑制因子和共激活因子)与DNA相互作用。人体内至少有18种HDACs已经被鉴定出来,其中主要是与酵母的去乙酰化酶具有同源性的4种(Xu et al. 2007)。HDAC抑制剂正在被研究作为癌症治疗化合物,因为它们能改变细胞功能,例如众所周知的放松对癌细胞的管制(Davis and Ross 2007)。
近年来,多项研究已经发现了姜黄素对HDAC表达的影响。其中,Bora-Tatar等人(2009)调查发现在33中羧酸衍生物中,姜黄素是最有效的HDAC抑制剂,它甚至比丙戊酸和丁酸钠(众所周知的HDAC抑制剂)更有效。另一项研究揭示经过姜黄素处理的HDAC1、3和8蛋白表达水平明显下降,同时导致乙酰化组蛋白H4的表达水平上升(Liu et al. 2005)。类似的,Chen 等人(2007)在用姜黄素处理后发现HDAC1和HDAC3的表达量也明显下降。
然而,HDAC2作为糖皮质激素的抗炎作用中和慢性阻塞性肺疾病患者肺功能受损及其香烟烟雾提取物中的主要成分,却是通过姜黄素里恢复的(Meja et al. 2008)。由于姜黄素在不同的HDAC酶亚型的影响不同,所以我们需要更深入的研究才能明白姜黄素对HDAC表达影响的内在机制。
HATs是一类酶,作为另外的膳食成分的重要指标,它能从乙酰辅酶A上转移乙酰基基团以形成e-N-乙酰赖氨酸,使组蛋白上保守的赖氨酸乙酰化。HATs包括至少25个部分,并被分成4个主要的具有结构同源性的家族(Lee and Workman 2007)。最近多项研究发现姜黄素是一种有效的HAT抑制剂。在2004年,Balasubramanyam等人发现姜黄素是一种特异性的p300/CREB-结合蛋白(CBP) HAT活性抑制剂,无论是在体内还是在体外,但它却并不是p300/CBP相关因子。除此之外,他们还发现姜黄素能在体内抑制p53的p300介导的乙酰化,同时能在体外显著抑制HIV-Tat蛋白的乙酰化和病毒的增殖(Balasubramanyam et al. 2004)。
其他的研究显示姜黄素既能作为一种在体内体外抑制p300/CBP HAT活性的特异性抑制剂,同时也能通过抑制p300 HAT的活性以防止大鼠患心衰(Morimoto et al. 2008)。Marcu等人发现姜黄素在p300/CBP上的结合位点是特异性的,而且这种结合会改变构象,导致组蛋白H3和H4与乙酰辅酶A的结合效率下降。
众所周知,姜黄素能诱导多种癌细胞株的凋亡,但是它的机制可能是多样的。例如,姜黄素诱导子宫颈癌细胞的凋亡,其实是通过特异性地抑制p300/CBP来抑制组蛋白和p53乙酰化(Balasubramanyam et al. 2004)。又比如,姜黄素通过诱导组蛋白低乙酰化,从而激活聚(ADP)核糖聚合酶-和caspase-3介导的脑胶质瘤细胞的凋亡(Kang et al. 2006)。
虽然组蛋白能在赖氨酸残基上被乙酰化或去乙酰化,但是HATs和HDACs也能改变费组蛋白乙酰化的状态(Sadoul et al. 2008)。通过乙酰化或去乙酰化调节转录因子、效应蛋白、分子伴侣和细胞骨架蛋白的表达正在逐渐成为一种重要的转录后水平的调节机制(Glozak et al. 2005)。
NF-jB作为一种促炎症转录因子,在它激活不同细胞过程中的数百种基因前是需要被乙酰化的(Chen et al. 2001;Gupta et al. 2010a)。NF-jB的乙酰化发生在多种带有p300/CBP乙酰转移酶的赖氨酸残基上。姜黄素能抑制p300介导的RelA的乙酰化,RelA是NF-jB的亚型,它能减弱与IjBa的相互作用,通过染色体区域maintenance-1依赖途径使IjBa依赖的复合体的核输出量下降(Chen et al. 2001)。同时,Yun等人(2010)发现经姜黄素处理能显著减弱HAT的活性、p300的水平以及乙酰化的CBP/p300基因的表达,最终抑制与NF-jB的结合。因此,姜黄素抑制p300/CBP HAT活性的能力可能与,或者部分与它抑制NF-jB的活性相关。
姜黄素也能抑制乙酰化的过度表达以及GATA4与DNA的结合能力,其中GATA4是小鼠心肌细胞中一种过度应答的转录因子,这种研究发现表明姜黄素对p300 HAT活性的抑制的功效可能会成为一种针对人类心脏病的新颖的治疗策略(Morimoto et al. 2008)。最后,姜黄素也能通过降低组蛋白H3和H4的乙酰化水平以诱导对神经干细胞存亡的再控制(Kang et al. 2006)。
既然姜黄素既能调节HDAC也能调节HAT,那么就可能存在一种潜在的共同机制。例如,氧化应激能通过激活内在的HAT活性以激活NF-jB,从而导致促炎介质的表达,但是同时它也能抑制HDAC的活性(Rahman et al. 2004)。就这点而论,姜黄素作为一种众所周知的抗氧化剂,可能能通过调控氧化应激,既能调节乙酰化也能调节去乙酰化。
三、 姜黄素在DNA甲基化方面的影响
DNA甲基化在调节正常的生物进程中发挥着至关重要的作用,但是在癌形成中不一样(Esteller 2007)。DNA甲基化是DNA结构上的一种可遗传的修饰,能直接阻止基因表达,但是并不改变编码基因组的碱基对的特异序列(Das and Singal 2004)。癌细胞的两种DNA甲基化图示已被检测出来:大范围的低甲基化,或者甲基化的减弱能促进静态促癌基因和转移前基因的表达以及促进肿瘤的发生,或者在一种特别的基因内部的启动子区分布着的特异性CpG岛上逐渐增加的甲基化,称之为局部高甲基化,比如肿瘤抑制基因,它会导致转录沉默,并失去控制肿瘤发生的能力(Ehrlich 2009)。DNA甲基化由DNA甲基化转移酶(包括DNMT1、DNMT3a、DNMT3b)调节,DNA甲基化转移酶存在在S-腺蛋氨酸的前面,S-腺蛋氨酸可提供甲基使C-5端胞嘧啶残基甲基化,以得到5-甲基胞嘧啶(Herman and Baylin 2003)。
目前仅仅少数的研究调查发现了姜黄素对DNA甲基化的影响。姜黄素和DNMT1之间的分子对接实验显示姜黄素可以共价催化DNMT1的硫醇盐基团,以此发挥DNMT1对DNA甲基化的抑制作用(Liu et al. 2009)。但是,一项最近的研究发现了一种不依赖姜黄素的去甲基化,研究显示姜黄素虽然作为一种DNMT抑制剂,却很少甚至没有相关的药理活性(Medina-Franco et al. 2010)。所以为了理清这些矛盾急切地需要更多更深入的调查研究。
在二甲基化药物FDA批准用于治疗骨髓增生异常综合征后,用5-氮胞苷和地西他滨处理会使癌细胞对化疗药物更敏感,这将对提出姜黄素的低甲基化能影响诱导癌细胞的化学增敏很有价值。有趣的是,一期试验中,在用多西他赛之前,让患有转移性乳腺癌的病人服用姜黄素数天,结果是8位病人中有5位病情部分缓解,有3位病情保持稳定(Bayet-Robert et al. 2011)。这种意外的结论可能是由于两种药剂巧妙而有顺序地被接收,使姜黄素在肿瘤治疗的表观遗传活性最大化。
- 姜黄素和DNA结合
姜黄素的抗氧化(Miquel et al. 2002)、抗炎(Surh 1999)、抗菌(Saleheen et al. 2002; Taher et al. 2003)以及化学预防(Aggarwal et al. 2003)的特性归因于多种多样的机制,包括抗血管生
剩余内容已隐藏,支付完成后下载完整资料

英语原文共 16 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[286282],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



