单细胞水平的脂质代谢和多通道追踪
原文作者:Christoph Thiele;Klaus Wunderling;Philipp Leyendecker
摘要:细胞脂质代谢是一个复杂的网络过程,由几十种酶、多种细胞器和一千多种脂质组成。在这个网络中追踪代谢反应是一项重大的技术和科学挑战。利用点击化学质谱报告策略,我们开发了一种针对炔烃标记脂质的特异、高灵敏度和稳健的追踪程序。该方法实现了样本复用,从而改进了样本比较。我们通过肝细胞甘油脂质代谢的时间分辨分析和120种标记脂质的平行定量监测来证明这一点。亚肌细胞敏感性使单细胞分析脂肪酸掺入中性和膜脂成为可能。结果表明,在单细胞水平上,脂质稳态具有稳定性。
代谢追踪是了解健康和疾病代谢途径复杂性的关键技术。脂肪酸含有正常营养中约三分之一的热量,但我们对其代谢动力学的了解有限,特别是对个别脂质种类的了解。对于脂肪酸追踪,我们之前介绍了一种基于炔烃标记脂肪酸、点击化学和荧光检测的系统。对脂肪酸代谢和鞘氨醇代谢敏感。标记前体的多样性确保了代谢途径的广泛覆盖。该系统有两个主要局限性:第一,检测极限在低皮摩尔范围内;第二,薄层色谱分离排除了脂质物种的分辨率。基于质谱(MS)的脂质体中获得的具有物种分辨率的示踪系统将为代谢分析开辟新途径。
在使用稳定同位素标记的基于质谱的追踪中,主要问题是在细胞提取物的背景中识别同位素标记的化合物。虽然已知反应有限的物质的代谢物可以通过有针对性的分析找到,但标记的脂肪酸被纳入数百种产品中,使分析复杂化。因此,同位素标记脂肪酸的可用示踪数据仅限于少数标记物种;缺少一种能够在物种水平上进行全面追踪的方法。如果能够设计一种可点击的报告分子,在功能上取代先前的荧光报告分子,炔标记的脂质将在基于MS的追踪中提供主要优势。这种分子应促进标记产物的电离,以特别增强其信号,提供可预测的质量位移,允许在MS1水平上直接识别,并提供诊断碎片,以在MS2水平上搜索标记化合物。
结果
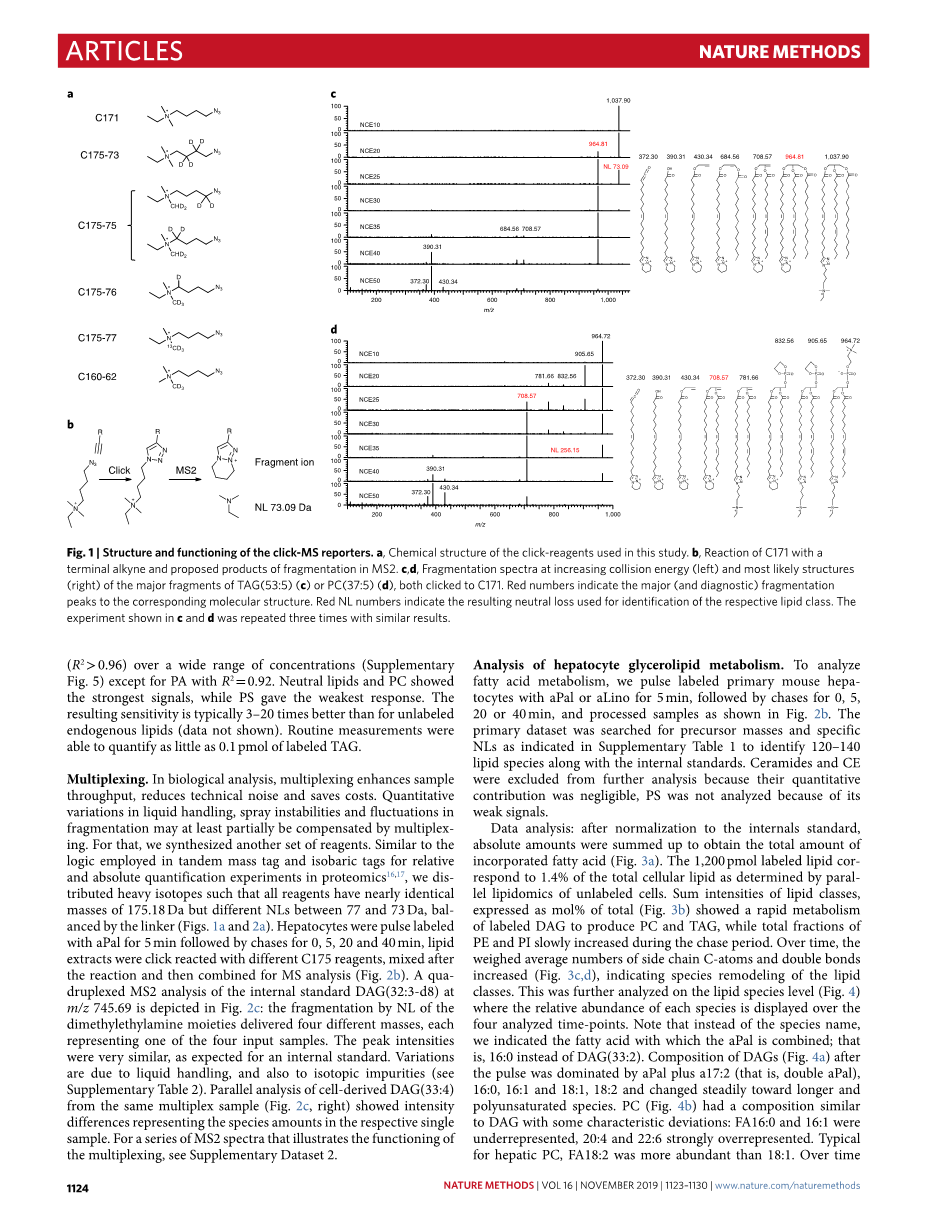
Click-质谱报告器。C171(图1a,补充材料中的合成)提供了这些功能,具有带电荷的报告基团、连接基和叠氮基,用于与标称质量位移为171 Da的末端炔烃反应(图1b)。正电荷能够实现有效电离,特别是对于中性脂质,如甘油三酯(比较补充图1和图2)。C171最重要的特征是它在MS2实验中的意外碎片。在中等碰撞能量下,标记化合物通过消除二甲基乙胺基团显示73.09 Da的定型中性损失(NL)(图1c)。未反应的C171未显示该NL(参见补充材料中的光谱),表明三唑环有助于消除,从而形成双环结构(图1b)。73.09的NL是中性脂质的诊断反应(补充图3),能够识别酰基甘油、神经酰胺、甾醇酯和游离脂肪酸。
磷脂显示磷脂二酯头基的平行NL,导致形成[DAG-HO](图1d)。双环三唑上的正电荷有利于头基NL,也有利于通常会失去正头基片段的磷脂,即磷脂酰胆碱(PC)和鞘磷脂(SM)。有效地,可以通过分析MS2中[头部基团 二甲基乙胺]的NL来识别标记磷脂(补充图4和补充表1)。对于PC和SM,双电荷单标记峰也出现在质谱图中(补充图2)。这些离子以73.09的NL断裂,同时在m/z 184.07 处释放磷酸胆碱头部基团,导致256.15 的损失。利用LipidXplorer将特征前体质量和特征碎片结合起来,用于自动识别标记的脂质,为计算中的前体、碎片和化学逻辑提供必要的灵活定义。
在原代肝细胞提取物中,用16-七烯二酸(aPal)标记,壬十二碳-9-顺式-en-18-炔诺酸(aOle)或十八碳-9,12-二烯-17-炔诺酸(aLino)我们从17个类脂中鉴定了250多种标记物种,显示了从三种不同标记中获得的物种光谱的特征差异(补充数据集1)。
通过内部标准化对追踪脂质进行绝对定量,我们合成了含有炔脂肪酸的标准脂质(磷脂酸PA、PC、磷脂酰乙醇胺PE、磷脂酰肌醇PI、磷脂酰丝氨酸PS、二酰甘油DAG、三酰甘油标签、胆固醇酯CE、神经酰胺Cer和双标记三酰甘油dlTAG),约占肝细胞总脂肪酸含量的96%。这些标准品还含有氘,从而形成天然脂质中未发现的独特质量,允许追踪奇数和偶数的炔脂肪酸。
这些标准品的稀释系列用于测定分析灵敏度和线性。在广泛的浓度范围内我们得到了线性响应(R2gt;0.96)(补充图5),R2=0.92的PA除外。中性脂质和PC表现出最强的信号,而PS的反应最弱。由此产生的敏感性通常是未标记内源性脂质的3-20倍(数据未显示)。常规测量能够量化0.1 pmol的标记标签。
图1|click-质谱报告中的结构和功能。a, 本研究中使用的click试剂的化学结构。b, C171与末端炔烃的反应以及MS2中的拟议碎片产物。c,d,增加碰撞能量时的碎片谱(左)和TAG(53:5)(c)或PC(37:5)(d)的主要碎片的最可能结构(右),均点击C171。红色数字表示对应分子结构的主要(和诊断)碎片峰。红色NL编号表示用于识别相应脂质类别的中性损失。这个在c和d中显示的实验重复三次,结果相似。
多路复用。在生物分析中,多路复用提高了样本吞吐量,降低了技术噪音并节约了成本。液体处理、喷雾不稳定性和碎片波动的定量变化至少可以通过多路复用部分补偿。为此,我们合成了另一组试剂。与串联质量标签和等压标签用于蛋白质组学中相对和绝对定量实验的逻辑相似,我们分配了重同位素,使得所有试剂的质量几乎相同,为175.18 Da,但在77和73 Da之间有不同的NLs,由连接子平衡(图1a和2a)。用aPal脉冲标记肝细胞5分钟,然后进行0、5、20和40分钟的追踪,脂质提取物与不同的C175试剂进行点击反应,反应后混合,然后组合用于MS分析(图2b)。图2c中描绘了m/z 745.69处内标DAG(32:3-d8)的四倍MS2分析:二甲基乙胺部分的NL裂解产生四种不同质量,每种质量代表四个输入样品中的一种。峰值强度非常相似,正如内部标准所预期的那样。变化是由于液体处理,以及同位素杂质(见补充表2)。对来自同一复合样本(图2c,右图)的细胞衍生DAG(33:4)的平行分析显示,代表各单一样本中物种数量的强度差异。有关说明多路复用功能的一系列MS2光谱,请参阅补充数据集2。
图2|多重代谢追踪。a, 使用C175-XX试剂的MS多路复用策略示意图。提取标记的样本并分别单击。将四个样本汇集在一起,得到MS1中的一个单峰,该单峰在MS2中分裂成四个峰,每个峰代表其原始样本。b, 肝细胞甘油脂质代谢代谢追踪的脉冲追踪实验设计。c, 上述实验的两个MS2光谱,显示DAG内标和细胞DAG。在追踪过程中,DAG被迅速代谢(右),标记的DAG信号减少(33:4)表明了这一点。c中显示的实验重复了12次,结果相似。
肝细胞甘油脂质代谢分析。为了分析脂肪酸代谢,我们用aPal或aLino脉冲标记原代小鼠肝细胞5分钟,然后追踪0、5、20或40分钟,并处理样品,如图2b所示。如补充表1所示,对主要数据集进行前体质量和特定NLs搜索,以确定120-140种脂质种类以及内部标准。神经酰胺和CE因其定量贡献可忽略不计而被排除在进一步分析之外,PS因其信号微弱而未被分析。
数据分析:标准化至内部标准后,将绝对量相加,以获得合并脂肪酸的总量(图3a)。1200 pmol标记的脂质相当于未标记细胞平行脂质组学测定的细胞总脂质的1.4%。脂质类别的总强度(以总的mol%表示)(图3b)显示标记的DAG快速代谢产生PC和TAG,而PE和PI的总分数在追逐期间缓慢增加。随着时间的推移,侧链C原子和双键的加权平均数增加(图3c,d),表明脂质类别的物种重塑。这在脂质物种水平上进一步分析(图4),其中在四个分析的时间点上显示了每个物种的相对丰度。注意,我们指出的不是物种名称,而是aPal与之结合的脂肪酸;也就是说,16:0而不是DAG(33:2)。脉冲后DAG的组成(图4a)主要由aPal加上a17:2(即双aPal)、16:0、16:1和18:1、18:2组成,并向更长的多不饱和物种稳定变化。PC(图4b)的成分与DAG相似,但存在一些特征偏差:FA16:0和16:1的比例偏低,20:4和22:6的比例偏高。FA18:2比18:1更丰富,这是肝脏PC的典型特征。随着时间的推移除了a17:2物种退化到16:0物种的水平外,变化不大。PE(图4c)含有90%的多不饱和脂肪酸(PUFA),几乎没有重塑,而PI(图4d)显示了20:4的特征优势,随着时间的推移,以较短的脂肪酸为代价增加。
PC的肝脏合成是两种途径的组合:肯尼迪途径利用甘油-3-磷酸酰化生成PA,随后去磷酸化生成DAG,最后转移磷酸胆碱生成PC。通过将磷酸乙醇胺转移到DAG,PE由磷脂酰乙醇胺N-甲基转移酶形成并甲基化,以产生PC。在图4中,在0分钟的追踪下把DAG、PC和PE进行比较表明,标记的PC池是通过将C16–C18 DAG与C20–C22 PEs结合形成的,这与先前的观点一致,即磷脂酰乙醇胺N-甲基转移酶途径对PC贡献了PUFA的主要部分。
与aPal类似,使用aLino标记的类别级分析(补充图6)显示,随着PC和TAG的相应增加,DAG迅速下降。对于aPal,标记的PC从20分钟轻微减少到40分钟。在六个独立实验中的每一个实验中都观察到了这种小的效应,很可能代表了将PC转化为TAG的途径。
图3 |实验的脂质水平分析如图2b所示。用aPal脉冲标记新鲜分离的肝细胞5分钟,然后进行0-40分钟的追踪,对实验的脂质水平进行分析。脂质提取物与C175试剂发生点击反应,汇集并通过多重质谱分析。使用LipidXplorer分析识别信号,并相对于内标物的信号进行量化。a, b,所有分析类别(a)的总掺入量和标记类别(b)c,d的相对摩尔百分比,加权平均类别链长(c)和双键数(d)的变化表明脂质类别内的物种重塑。请注意,d中的双键数不包含用于标记的炔脂肪酸的三键。条形图表示三个副本的平均值,单个值显示为黑色符号。实验重复了三次,结果相似。
与aPal的观察相反,随着时间的推移,所有磷脂和DAG显示出链长和双键的系统性减少,而TAG显示出长度和双键数的增加。
在物种水平上(图5),DAG主要包含FAs 16:0、16:1、18:0和18:1。很少有FA20:4或FA22:6与aLino结合。在5分钟的追踪中,双阿利诺DAG的初始强度峰值迅速下降(从310 pmol降至32 pmol),PC和PE的相应物种也观察到了这一现象。对于PC,16:0-aLino物种的比例稳步增加,直到40分钟追逐后成为优势物种,这与内源性PC对FA16:0–18:2的偏好一致。PI出现重塑,强双aLino和FA18:2组合迅速降解。FA18:1最初弥补了多不饱和脂肪酸的减少,然后随着FA16:0和FA18:0成为主要物种而减少(从9%降至47%)。由于标记PI的总量基本上没有变化,因此大部分代表了实际的脂肪酸重塑,可能是通过DDHD1,去除sn-1脂肪酸,然后通过偏好FA18:0的LYCAT进行再酰化。
单细胞代谢追踪。反应后的中性脂质检测灵敏度高。例如,补充图2中的样品以相当于每分钟70个细胞的速度注入光谱仪,导致许多峰的强度大于107。在Orbitrap探测器中,可以可靠地检测到103的信号强度,这表明每分钟一个标记细胞就足以进行定量分析。
为了实现单细胞灵敏度,我们将样品体积从500micro;L减少到20micro;L,并将数据记录调整为小样品体积的有限喷雾时间。通过限制稀释法采集细胞样本,共鉴定出46种标记的PC、TAG和双标记的TAG。在每管0.5个细胞的标称浓度下,我们观察到几个标记脂质含量极低的样品(图6a,样品2和4-10)和两个标记脂质含量较高的样品(图6a,样品1和3)。在较高的标称浓度下,低计数频率降低,强度发生较大变化,与样品中细胞数的预期泊松分布一致。我们通过减去样品6-9的平均值,乘以考虑样品稀释的系数,对数据进行背景校正。校正后的数据集(图6b)用于估计样本中的细胞数量。有一个群体的总标记脂质范围为120至290 fmol。由于肝细胞表现为单核和双核细胞,细胞体积变化较大,因此有理由假设该群体由单个细胞组成,而300-600 fmol之间的群体代表两个细胞。我们重复了实验,收集了大量细胞,每个样本名义上0.8个细胞,得到19个单细胞,用于进一步分析。补充图7显示了一个具有代表性的单细胞的光谱,该细胞涵盖了三个脂质类别和44个物种。物种模式与多细胞分析结果基本相同,但在20micro;l样品(10pM)中,定量限降至0.2 fmol标记的脂质。
图4|aPal标记的甘油脂质的脂肪酸重塑。如图3所示处理肝细胞,并将信号标准化为各类别总信号的百分比。a–d,如横坐标所示,aPal与脂肪酸结合,得到DAG(a)、PE(<s
剩余内容已隐藏,支付完成后下载完整资料</s

英语原文共 13 页,剩余内容已隐藏,支付完成后下载完整资料
资料编号:[598127],资料为PDF文档或Word文档,PDF文档可免费转换为Word
您可能感兴趣的文章
- 饮用水微生物群:一个全面的时空研究,以监测巴黎供水系统的水质外文翻译资料
- 步进电机控制和摩擦模型对复杂机械系统精确定位的影响外文翻译资料
- 具有温湿度控制的开式阴极PEM燃料电池性能的提升外文翻译资料
- 警报定时系统对驾驶员行为的影响:调查驾驶员信任的差异以及根据警报定时对警报的响应外文翻译资料
- 门禁系统的零知识认证解决方案外文翻译资料
- 车辆废气及室外环境中悬浮微粒中有机磷的含量—-个案研究外文翻译资料
- ZigBee协议对城市风力涡轮机的无线监控: 支持应用软件和传感器模块外文翻译资料
- ZigBee系统在医疗保健中提供位置信息和传感器数据传输的方案外文翻译资料
- 基于PLC的模糊控制器在污水处理系统中的应用外文翻译资料
- 光伏并联最大功率点跟踪系统独立应用程序外文翻译资料



